-
Détails
-
Écrit par administrator
-
Catégorie : Uncategorised
-
-
Affichages : 2019
Pluton (planète naine)
(134340) Pluton
Photographie en couleurs quasi-réelles de Pluton prise par la sonde
New Horizons le 14 juillet 2015.
Caractéristiques orbitales
Époque : (JJ 2454000,5)[1]
Établi sur 4 379 observ. couvrant 33102 jours (U = 0)
| Demi-grand axe (a) |
5 900 898 440,583 108 67 km[1]
(39,445 069 7 ua) |
|---|
| Périhélie (q) |
4 436 824 613 km[1]
(29,573 391 7 ua) |
|---|
| Aphélie (Q) |
7 375 927 931 km[1]
(49,316 147 6 ua) |
|---|
| Excentricité (e) |
0,250 248 71[1] |
|---|
| Période de révolution (Prév) |
90 487,276 9 j[1]
(247.74 a) |
|---|
| Vitesse orbitale moyenne (vorb) |
4,74 km/s |
|---|
| Moyen mouvement (n) |
0,003 978 45°/j[1] |
|---|
| Inclinaison (i) |
17,089 000 9°[1] |
|---|
| Longitude du nœud ascendant (Ω) |
110,376 956°[1] |
|---|
| Argument du périhélie (ω) |
112,597 141 7°[1] |
|---|
| Anomalie moyenne (M0) |
25,247 189 7°[1] |
|---|
| Date de dernier périhélie (Tp) |
JJ 2 447 778,716 79[2]
() |
|---|
| Catégorie |
Plutoïde (planète naine transneptunienne), plutino |
|---|
| Satellites connus |
5 : Charon, Hydre, Nix, Kerbéros, Styx |
|---|
| DMIO terrestre |
28,603 1 ua[1] |
|---|
| Paramètre de Tisserand (TJ) |
5,228[1] |
|---|
modifier 
Pluton, officiellement désignée par (134340) Pluton (désignation internationale : (134340) Pluto), est une planète naine, la plus volumineuse connue dans le Système solaire (2 372 km de diamètre, contre 2 326 km pour Éris), et la deuxième en ce qui concerne sa masse (après Éris). Pluton est ainsi le neuvième plus gros objet connu orbitant directement autour du Soleil et le dixième par la masse. Premier objet transneptunien identifié, Pluton orbite autour du Soleil à une distance variant entre 30 et 49 unités astronomiques et appartient à la ceinture de Kuiper, ceinture dont il est (tant par la taille que par la masse) le plus grand membre connu.
Après sa découverte par l'astronome américain Clyde Tombaugh en 1930, Pluton était considérée comme la neuvième planète du Système solaire. À la fin du XXe siècle et au début du XXIe siècle, de plus en plus d'objets similaires furent découverts dans le Système solaire externe, en particulier Éris, alors estimé légèrement plus grand et plus massif que Pluton. Cette évolution amena l'Union astronomique internationale (UAI) à redéfinir la notion de planète, Cérès, Pluton et Éris étant depuis le classées comme des planètes naines. L'UAI a également décidé de faire de Pluton le prototype d'une nouvelle catégorie d'objets transneptuniens. À la suite de cette modification de la nomenclature, Pluton a été ajoutée à la liste des objets mineurs du Système solaire et s'est vu attribuer le numéro 134340 dans le catalogue des objets mineurs.
Pluton est principalement composée de roche et de glace de méthane, mais aussi de glace d'eau et d'azote gelé. Son diamètre est d'environ les deux tiers de celui de la Lune.
Pluton est le corps principal du système plutonien. Le couple que forme Pluton avec son grand satellite, Charon (diamètre 1 200 kilomètres), est souvent considéré comme un système double, car la différence de masse entre les deux objets est l'une des plus faibles de tous les couples corps primaire/satellite du système solaire (rapport 8:1) et le barycentre de leurs orbites ne se situe pas à l'intérieur d'un des deux corps (il est légèrement à l'extérieur de Pluton).
Quatre autres satellites naturels, nettement plus petits et tous en orbite à peu près circulaire (excentricité < 0,006) à l'extérieur de l'orbite de Charon, complètent le système tel qu'actuellement connu (dans l'ordre en s'éloignant) : Styx, Nix, Kerbéros et Hydre. Tous quatre furent découverts avec l'aide du télescope spatial Hubble : les deux plus importants, Nix et Hydre (respectivement 54 × 41 × 36 km et 43 × 33 km), en 2005, Kerbéros (environ 12 × 4 km) en 2011 et Styx (environ 7 × 5 km) en 2012. Ces deux derniers ont reçu leur nom officiel en . Les dimensions mentionnées correspondent à des mesures effectuées ultérieurement à leur découverte, et non aux premières estimations qui purent être faites.
La sonde spatiale New Horizons, lancée en par la NASA, est la première sonde à explorer le système plutonien ; elle le traverse le à une distance minimale de 11 095 km de Pluton, après un voyage de 6,4 milliards de kilomètres. La sonde ne détecte aucun autre satellite de plus de 1,7 km de diamètre pour un albédo de 0,5.
Historique
Pré-découvertes
D'après Greg Buchwald, Michel DiMario et Walter Wild, Pluton a été photographiée le 21 août et le 11 novembre 1909 à l'observatoire Yerkes de l'université de Chicago[6]. Cependant, leurs coordonnées n'apparaissent pas dans la liste des quatorze autres pré-découvertes de Pluton qui sont recensées[6] dans les données du Minor Planet Center. La toute première officiellement identifiée est celle du à l'observatoire du Königstuhl de Heidelberg[6].
Découverte
 Clyde Tombaugh, l'homme qui a découvert Pluton.
Clyde Tombaugh, l'homme qui a découvert Pluton.
 Astrographe de l'observatoire Lowell ayant servi à la découverte de Pluton.
Astrographe de l'observatoire Lowell ayant servi à la découverte de Pluton.
En métal gris, le dispositif photographique.
Pluton fut découvert en 1930 lors de la recherche d'un corps céleste permettant d'expliquer les perturbations orbitales de Neptune, hypothèse proposée par Percival Lowell comme la planète X.
Ayant fait fortune dans les affaires, Lowell se fait construire en 1894 un observatoire à plus de 2 000 m d'altitude dans l'Arizona et entreprend la recherche d'une neuvième planète au-delà de Neptune. Il pense suivre la même méthode que celle qui avait conduit à la découverte de cette dernière en étudiant son orbite, mais la précision des instruments de l'époque ne permettant pas de mesurer de façon précise les anomalies orbitales, il doit se rabattre sur celles d'Uranus. Sa planète (baptisée « X ») serait située à 47,5 ua, aurait une période de 327 ans et une masse de deux cinquièmes de celle de Neptune. En 1905, il lance une première campagne photographique de trois ans, mais celle-ci ne donne rien de concluant, notamment, comme il fut démontré par la suite, parce que ce programme était focalisé sur l'écliptique et que l'orbite fortement inclinée de Pluton la plaçait à cette époque en dehors du champ des photographies[7]. Lowell ne baisse pas les bras pour autant et décide de redoubler d'efforts, notamment lorsqu'il voit apparaître un concurrent : William Pickering. Celui-ci annonce en 1908 la présence d'une planète qu'il nomme « O » de deux masses terrestres, à une distance de 52 ua et d'une période de 373 ans. En 1911, Lowell fait l'acquisition d'un comparateur à clignotement, machine destinée à l'analyse photographique lui permettant de comparer les clichés beaucoup plus vite (deux séries de photos sont prises à quelques jours d'intervalle pour repérer le mouvement éventuel d'un astre) et entame une nouvelle série de photographies[8]. Ce nouvel échec le mènera à se désintéresser de sa planète X.
Percival Lowell meurt en 1916 mais laisse dans son testament de quoi poursuivre les recherches sans se soucier des problèmes d'argent, bien que des problèmes d'héritage avec sa femme finissent par réduire le budget de l'observatoire. Or dix ans plus tard, l'observatoire doit se doter d'un nouvel instrument. Abbott Lawrence Lowell, le frère de Percival Lowell, accepte de donner dix mille dollars pour la construction d'un télescope de 13 pouces que Clyde W. Tombaugh sera chargé de piloter pour cette lourde tâche qu'est la cartographie minutieuse du ciel, à la recherche de la planète X. Tombaugh réorganise son plan de travail et procède à trois prises au lieu de deux afin d'augmenter les chances de percevoir le mouvement de la planète. La troisième série de clichés prend fin le et commence alors l'analyse des plaques photographiques. Le , il remarque un point qui bouge d'une plaque à l'autre sur deux photographies prises les 23 et 29 janvier[4]. L'équipe de l'observatoire Lowell, après avoir pris d'autres photographies permettant de confirmer la découverte, télégraphie la nouvelle au Harvard College Observatory le [9]. La découverte est annoncée le par une circulaire de l'Union astronomique internationale[10].
 Une partie du bassin Burney, région de Pluton nommée d'après Venetia Burney[11].
Une partie du bassin Burney, région de Pluton nommée d'après Venetia Burney[11].
De nombreux observatoires se mettent alors à observer cette nouvelle planète, afin de déterminer son orbite le plus précisément possible. En reprenant des clichés antérieurs, Pluton est rétroactivement observée sur des plaques photographiques remontant jusqu'à 1909[12].
La planète est nommée à la fois en référence au dieu romain des enfers et à Percival Lowell dont les initiales forment les deux premières lettres de Pluton. Ses initiales forment le premier symbole astronomique et astrologique de Pluton : ♇[13],[14] (Il y a aussi un deuxième symbole planétaire, ⯓[15]. Ces symboles sont rares en astronomie aujourd'hui, mais courants en astrologie). Le nom fut suggéré par Venetia Burney, une jeune fille de onze ans d'Oxford, en Angleterre. Passionnée de mythologie et d'astronomie, Venetia Burney trouva approprié d'associer le nom du dieu du monde souterrain à ce monde obscur et glacé. Son grand-père qui travaillait à la bibliothèque universitaire d'Oxford en parla à l'astronome Herbert Hall Turner, qui transmit l'idée à ses confrères américains[16]. Le nom de Pluton fut officialisé le [17].
Pluton et la planète X
 Découverte de Charon satellisant Pluton, photographie de 1978.
Découverte de Charon satellisant Pluton, photographie de 1978.
À l'origine, la découverte de Pluton est liée à la recherche systématique d'une planète permettant d'expliquer les perturbations observées dans les orbites d'Uranus et Neptune, mais le doute est très vite jeté sur le fait que Pluton serait bien la planète X que Percival Lowell recherchait[18].
À cette époque, Pluton est si lointaine que son diamètre ne peut pas être déterminé avec précision, mais sa faible luminosité et son absence de disque apparent laissent présager un corps plutôt petit, comparable en taille aux planètes telluriques déjà connues, probablement plus grand que Mercure mais pas plus que Mars, pense-t-on à l'époque[19]. Il devient donc rapidement clair que Pluton ne peut pas être la source des perturbations dans les orbites de Neptune et Uranus. Clyde Tombaugh et d'autres astronomes persévèrent dans la recherche de la planète X pendant 12 ans, mais ne découvrent que des astéroïdes et des comètes[18]. Les astronomes sont amenés à imaginer que de nombreux autres corps similaires à Pluton pourraient orbiter autour du Soleil au-delà de Neptune. On pense alors que le système solaire pourrait être constitué de plusieurs zones regroupant les corps célestes par familles, planète tellurique, planète géante, « objets ultra-neptuniens »[19]. Cette hypothèse sera formalisée plus tard au cours des années 1940 et 1950 par Kenneth Edgeworth puis Gerard Kuiper, et est désormais connue sous le nom de ceinture de Kuiper[20].
Le premier satellite de Pluton fut découvert le lorsque James W. Christy réalisa que l'image de Pluton apparaissant sur des plaques photographiques prises dans les deux mois précédents semblait présenter une protubérance tantôt d'un côté, tantôt de l'autre[21],[22]. La protubérance fut confirmée sur d'autres plaques, dont la plus ancienne remontait au . Des observations ultérieures de la protubérance montrèrent qu'elle était causée par un petit corps. La périodicité de la protubérance correspondait à la période de rotation de Pluton, laquelle était connue à partir de sa courbe de luminosité, indiquant une orbite synchrone et suggérant qu'il s'agissait d'un effet réel et non d'un artefact d'observation. Le nom de Charon fut donné au satellite.
En 1993, les calculs de la trajectoire de survol de Neptune par la sonde Voyager 2 en août 1989[23] ont montré que Neptune avait une masse inférieure aux hypothèses précédentes, et en tenant compte de cette nouvelle mesure, le mathématicien Myles Standish montre que les divergences dans les mouvements des planètes Uranus et Neptune deviennent négligeables devant l'incertitude de la mesure liée à la précision des instruments. L'hypothèse d'une planète X perturbatrice ne tient donc plus, et c'est donc sur la base d'une prédiction de position fausse que Pluton fut découverte[24].
Statut de planète naine
Dans la dernière décennie du XXe siècle, la découverte de nombreux objets transneptuniens (plus d'un millier), dont certains ont une dimension estimée voisine de celle de Pluton (par exemple Éris), pousse à la remise en question de son statut de planète[25].
Parmi ceux-ci, de très nombreux corps sont découverts qui possèdent une période de révolution égale à celle de Pluton, et sont comme lui en résonance 2:3 avec Neptune[25].
Certains scientifiques proposent alors de reclasser Pluton en planète mineure ou en objet transneptunien. D'autres, comme Brian Marsden du Centre des planètes mineures, penchent pour lui attribuer les deux statuts, en raison de l'importance historique de sa découverte. Marsden annonce le 3 février 1999 que Pluton serait classée comme le 10 000e objet du catalogue recensant justement 10 000 planètes mineures. Le numéro rond de « 10000 » serait attribué à Pluton en son honneur pour la « célébration » de ce compte atteint. L'Union astronomique internationale (UAI), l'organisme coordinateur de l'astronomie au niveau international, chargé de la dénomination des corps célestes ainsi que de leur statut, fit alors une mise au point, rappelant qu'elle seule était habilitée à déterminer le statut de Pluton[26].
Historiquement, les quatre premiers astéroïdes découverts de 1801 à 1807 — (1) Cérès, (2) Pallas, (3) Junon et (4) Vesta — furent eux aussi considérés comme des planètes pendant plusieurs décennies (à l'époque, leurs dimensions n'étaient pas connues avec précision). Certains textes astronomiques du début du XIXe siècle font référence à onze planètes (incluant Uranus et les quatre premiers astéroïdes). Le cinquième astéroïde ((5) Astrée) fut découvert en 1845 peu de temps avant la découverte de Neptune, suivi de plusieurs autres dans les années suivantes. Dans les années 1850, on cessa de considérer ces objets de plus en plus nombreux comme des « planètes », pour les nommer « astéroïdes » ou « planètes mineures »[27].
La découverte en 2005 de (136199) Éris[a], d'un diamètre comparable et d'une masse légèrement supérieure à ceux de Pluton, contribue à relancer le débat ; puisqu'il s'agit en effet de ne pas reproduire le même scénario que ce qui s'était passé pour Cérès, Pallas, Junon et enfin Vesta. Le diamètre d'Éris, qui avait initialement été estimé à 3 600 km (il semblait alors notablement plus grand que Pluton) était encore en 2006 du même ordre de grandeur que celui de Pluton, même après avoir été revu à la baisse (2 400 ± 100 km). Selon une étude publiée dans Science du , sa masse serait supérieure à celle de Pluton d'environ 27 %[28]. De nombreux autres corps ont également été découverts à cette époque, tels que (136472) Makémaké, (90482) Orcus ou (90377) Sedna, régulièrement annoncés comme la dixième planète du Système solaire.
La classification en neuf planètes devient difficilement tenable. Le dernier mot revient à l'UAI, qui, lors de son 26e congrès tenu le 24 août 2006 en République tchèque, a décidé au terme d'une semaine de débats de compléter la définition de planète, disant qu'une planète élimine de son voisinage tous les objets ayant une taille qui lui soit comparable[29]. Ce qui n'est pas le cas de Pluton, qui partage son espace avec d'autres objets transneptuniens et qui est reclassé en planète naine[26],[30],[31]. Le Centre des planètes mineures lui attribua le 7 septembre 2006 le numéro d'objet mineur « 134340 »[32]. (134340) Pluto devient la désignation officielle de l'Union astronomique internationale le 13 septembre 2006[33],[34].
Néanmoins, à la suite du vote, une pétition[35] ayant réuni en cinq jours les signatures de plus de 300 planétologues et astronomes majoritairement américains (Pluton ayant été la première planète découverte par un Américain) a été lancée pour contester la validité scientifique de la nouvelle définition de planète qui déclassait Pluton ainsi que son mode d'adoption et inviter à la réflexion sur une autre définition plus appropriée[36]. Il faut dire que lors du 26e congrès de Prague qui s'est tenu du 14 au , le vote sur la rétrogradation ou non de Pluton a eu lieu seulement le 24 août[37] et en présence de 400 membres environ sur 6 000[38], ce qui peut remettre en cause le bien-fondé de la décision. Néanmoins, Catherine Cesarsky, présidente de l'UAI, clôt le débat en décidant que l'assemblée de l'UAI d'août 2009 ne reviendrait pas sur la définition de planète[39]. Des planétologues continuent cependant à parler de Pluton comme d'une planète en 2018, tel Alan Stern[b].
Le 18 septembre 2014, le Harvard-Smithsonian Center for Astrophysics organise un débat réunissant trois experts présentant trois points de vue de la définition d'une planète : historique, la définition retenue par l'UAI et enfin le point de vue des chercheurs des exoplanètes ; ce dernier, présenté par Dimitar Sasselov, président de Harvard Origins of Life Initiative, recueille l'adhésion des experts, pour lesquels Pluton serait donc bien une planète[40],[41].
Pluton conserve son importance
 Lancement de la sonde New Horizons par une fusée Atlas V.
Lancement de la sonde New Horizons par une fusée Atlas V.
Environ cent-cinquante objets orbitant comme Pluton avec une résonance 2:3 avec Neptune étaient recensés en février 2006, ce qui tend à montrer que Pluton est le plus grand représentant d'une vaste famille de corps plus ou moins massifs. Les astronomes David Jewitt et Jane Luu proposent de les nommer « plutinos »[25].
Une nouvelle sous-catégorie, les plutoïdes, est créée par l'UAI pour les planètes naines qui passent la majeure partie de leur révolution orbitale à l'extérieur de l'orbite de Neptune, dont Pluton fait partie[42].
Observations du télescope spatial Hubble
Le télescope spatial Hubble a fourni les images les plus détaillées de la surface de Pluton avant l'arrivée de New Horizons[43].
-
Image prise par
Hubble en 1994
[44].
-
Surface de Pluton établie en 1994 en haut, à partir des observations de la caméra pour objets faibles (Faint Object Camera) et entre 2002 et 2003 par la caméra avancée pour les relevés (Advanced Camera for Surveys) en bas, toutes deux des instruments de
Hubble.
-
Carte reconstituée de Pluton en vraies couleurs générée par ordinateur à partir d'images d'
Hubble[c] et parmi les plus hautes résolutions possibles avec la technologie de 2010. Ce qui fut plus tard nommé la
région Tombaugh (le « cœur de Pluton ») était déjà visible (tache brillante autour de 180°). Autres photos de toute la surface
ici [archive].
Exploration de Pluton
 Image en haute définition utilisant des couleurs améliorées (combinaison des images bleues, rouges et infrarouges), 14 juillet 2015.
Image en haute définition utilisant des couleurs améliorées (combinaison des images bleues, rouges et infrarouges), 14 juillet 2015.
Pluton est un objectif difficile pour l'exploration spatiale, à cause de la grande distance la séparant de la Terre (environ 4,8 milliards de kilomètres[45]), de la forte inclinaison de son orbite (17°) sur l'écliptique et de sa très faible masse.
À titre de comparaison, si la Terre était un ballon de football (70 cm de circonférence), Pluton aurait environ la taille d'une balle de golf. À cette échelle, une distance de 86 kilomètres séparerait les deux planètes, soit 20 tours du circuit Gilles-Villeneuve ou la distance de Paris à Évreux.
La sonde Voyager 1 aurait éventuellement pu l'atteindre, mais l'exploration de Titan (le plus grand satellite parmi les innombrables que comporte Saturne) et des anneaux de Saturne fut jugée plus importante, ce qui eut pour effet de rendre sa trajectoire incompatible avec un rendez-vous avec Pluton. Voyager 2 n'était pas en mesure de l'atteindre car la trajectoire théorique de la sonde pour réaliser ce rendez-vous aurait supposé de traverser la planète Neptune[46].
 Image de l'hémisphère de Pluton opposé à Charon, 11 juillet 2015.
Image de l'hémisphère de Pluton opposé à Charon, 11 juillet 2015.
La NASA étudia en 1991 un projet de sonde vers Pluton, qui fut révisé à la baisse en 1992 puis abandonné en 1994. Un nouveau projet américano-russe, la mission Pluto Kuiper Express, démarra en 1995. Il aurait eu pour but le survol vers 2012 du couple Pluton/Charon, et d'au moins un objet de la ceinture de Kuiper. La Nasa l'annula en 2000, pour des raisons budgétaires[47].
Elle a finalement été remplacée par une mission similaire, New Horizons. La sonde New Horizons, lancée le , est donc la première sonde spatiale à visiter Pluton, bénéficiant en février 2007 de l'assistance gravitationnelle de Jupiter[48] pour arriver au plus près de la planète naine le , après un voyage de 6,4 milliards de kilomètres. Les observations débutent environ cinq mois avant le plus proche passage et devraient continuer environ un mois après. Le survol est toutefois si rapide que seul un hémisphère peut être photographié avec la résolution la plus élevée[49]. L'engin spatial emporte à son bord des instruments d'imagerie, de spectroscopie et d'autres appareils de mesure, afin de déterminer les caractéristiques géologiques et morphologiques de Pluton et de sa lune Charon, mais aussi cartographier les éléments composant leur surface et étudier l'atmosphère de Pluton (composition et taux d'évasion). La mission prévoit également un survol des objets de la ceinture de Kuiper jusqu'en 2025[50].
Orbite
L'orbite de Pluton autour du Soleil a été observée pendant plus d'un siècle (le cliché le plus ancien sur lequel on repère Pluton remonte à janvier 1914), durée de parcours d'un peu plus du tiers de sa trajectoire annuelle, mais suffisante pour mesurer avec précision ses caractéristiques orbitales[24].
 Vue de l'orbite de Pluton par rapport à l'écliptique. L'orbite de Pluton (en rouge) montre la grande différence d'inclinaison avec l'écliptique de la Terre.
Vue de l'orbite de Pluton par rapport à l'écliptique. L'orbite de Pluton (en rouge) montre la grande différence d'inclinaison avec l'écliptique de la Terre.
Paramètres orbitaux
 Vue polaire sur l'orbite de Pluton en rouge, de Neptune en bleu. La position présentée est celle du 16 avril 2006, le mouvement des deux corps se fait selon le sens antihoraire (prograde).
Vue polaire sur l'orbite de Pluton en rouge, de Neptune en bleu. La position présentée est celle du 16 avril 2006, le mouvement des deux corps se fait selon le sens antihoraire (prograde).
Le périhélie et l'aphélie sont marqués respectivement par q et Q.
Orbite
Le demi-grand axe de l'orbite de Pluton est de 39,88 ua[51], mais du fait de l'excentricité prononcée de cette orbite, la distance entre Pluton et le Soleil varie entre 29,7 ua au périhélie et 49,5 ua à l'aphélie, et l'année plutonienne dure 248,1 années terrestres[52].
Inclinaison
En comparaison des planètes classiques du système solaire, l'orbite de Pluton est fortement inclinée par rapport au plan de l'écliptique (17,14175°) et excentrique (0,24880766). Les orbites des planètes classiques sont quasi circulaires et coplanaires de l'écliptique (seule Mercure possède une orbite inclinée (7°) et excentrique (0,2) de manière significative).
Comparaison avec Neptune
Le périhélie de Pluton est situé à plus de 8,0 ua au-dessus du plan de l'écliptique, soit 1,2 milliard de km, et c'est près de cette position de son orbite que la planète naine se trouve plus proche du Soleil que Neptune. Ce fut le cas pendant vingt ans entre le et le . À l'opposé, Pluton s'éloigne de 13 ua au-dessous du plan de l'écliptique[53].
Croisements avec d'autres astéroïdes
 L'orbite de Pluton.
L'orbite de Pluton.
L'orbite de Pluton étant très excentrique, elle croise celle de nombreux autres objets ; parmi les astéroïdes numérotés, ces hadéocroiseurs comptaient (en ) 10 frôleurs intérieurs (dont (5145) Pholos), 24 frôleurs extérieurs (dont (19521) Chaos), 17 croiseurs (dont (38628) Huya) et 37 coorbitaux (dont (20000) Varuna, (28978) Ixion et (50000) Quaoar)[54].
Résonance orbitale
 Ce diagramme indique les positions relatives de Pluton (en rouge) et Neptune (en bleu) à certaines dates. Les tailles de Neptune et Pluton sont représentées comme inversement proportionnelles à leur distance. L'approche minimale a eu lieu en juin 1896 à 18,9 ua, soit plus de 2,8 milliards de kilomètres.
Ce diagramme indique les positions relatives de Pluton (en rouge) et Neptune (en bleu) à certaines dates. Les tailles de Neptune et Pluton sont représentées comme inversement proportionnelles à leur distance. L'approche minimale a eu lieu en juin 1896 à 18,9 ua, soit plus de 2,8 milliards de kilomètres.
Bien que Pluton soit parfois plus proche du Soleil que Neptune, les orbites des deux objets ne se croisent jamais, en raison de la forte inclinaison (environ 17°) de l'orbite de Pluton par rapport au plan de l'écliptique. Les nœuds de l'orbite de Pluton (les points où l'orbite traverse le plan de l'écliptique) sont situés à l'extérieur de l'orbite de Neptune[53].
Pluton est en résonance avec Neptune de rapport 3:2, c'est-à-dire que sur une durée de 496 ans, Pluton effectue deux révolutions autour du Soleil pendant que Neptune en réalise trois. Cette résonance est stable : une perturbation de l'orbite de Pluton serait corrigée par l'attraction de Neptune. À cause de ce phénomène, Pluton et Neptune ne sont jamais plus proches que 18,9 ua, tandis que Pluton peut s'approcher à 12 ua d'Uranus. Quand Neptune dépasse le point où les deux orbites sont les plus proches, la résonance maintient une séparation angulaire Neptune-Soleil-Pluton supérieure à 50° et Pluton reste près de 30 ua derrière Neptune, soit près de 4,5 milliards de kilomètres. Le vrai point de rapprochement se situe de l'autre côté de l'orbite. Neptune « dépasse » toujours Pluton quelque 30 ans après l'aphélie de ce dernier[55].
D'autres objets transneptuniens qui gravitent sur une orbite dont le demi-grand axe est de 39,4 ua possèdent une telle résonance orbitale 3:2 avec Neptune et sont appelés des plutinos, par référence à Pluton[56],[57]. En 2009, on en compte plus de 200[58].
Caractéristiques physiques
Si la trajectoire de Pluton a pu être déterminée sans grande difficulté, ses caractéristiques physiques (diamètre, masse, et partant densité, pouvoir réflecteur, état de la surface) sont restées longtemps mal connues et controversées : son diamètre apparent est inférieur à ¼ de seconde d'arc, tandis que les turbulences de l'atmosphère terrestre rendent difficile l'observation de détails inférieurs à une seconde d'arc[59]. La finesse des observations s'est accrue à partir des années 1980, par l'usage de l'optique adaptative, de la spectrométrie, et du télescope spatial Hubble[60]. La découverte en 1978 d'un satellite de Pluton, Charon, offrit des moyens d'investigation supplémentaires[61]. Néanmoins en 2010, les valeurs publiées diffèrent encore quelque peu selon que l'on se réfère à la NASA[62] ou à des publications récentes[63],[64]. Le survol en 2015 par la mission New Horizons et les effets gravitationnels du couple Pluton-Charon sur la sonde permettront d'ajuster les valeurs de son champ de gravité, selon l'observation de l'effet Doppler sur les signaux de la sonde et la déduction qui en résulte des variations de sa vitesse et de son accélération induite par Pluton et Charon[65].
Rotation
En 1955, on observe que les variations de la luminosité de Pluton sont de l'ordre de 30 % et sont périodiques. On en déduit que Pluton tourne sur elle-même en 6,387 jours, soit 6 jours, 9 heures et 17 minutes[66]. Son axe de rotation est incliné de 57,5° par rapport à son plan orbital, ce qui est plutôt élevé et inhabituel dans le Système solaire (seule Uranus a une inclinaison comparable)[67]. Aux points de solstice de son orbite, Pluton expose donc un pôle au Soleil pendant de nombreuses décennies, et aux points d'équinoxe, soit tous les 124 ans, il tourne comme sur une broche face au Soleil, tandis que la Terre voit verticalement sa ligne d'équateur ainsi que l'orbite de Charon, qui passe alternativement devant et derrière Pluton[68].
L'action des forces de marée a contraint la période de rotation de Pluton jusqu'à la synchroniser avec la période de révolution de son principal satellite, Charon : les deux périodes étant égales, Charon se trouve donc toujours à la verticale du même point de la surface de Pluton[d], et Charon paraît donc immobile dans le ciel plutonien[69].
Masse et dimensions
Pluton, avec sa masse d'un cinq-centième de celle de la Terre et un diamètre de 2 370 ± 20 km, est plus petite et moins massive que sept satellites naturels dans le Système solaire : la Lune (3 476 km de diamètre), les quatre satellites galiléens de Jupiter (Ganymède, 5 262 km ; Callisto, 4 880 km ; Io, 3 640 km ; Europe, 3 122 km), le plus gros satellite de Saturne (Titan, 5 150 km) et celui de Neptune (Triton, 2 706 km)[70].
Dimensions
Estimations de la taille de Pluton
| Année | Rayon et (diamètre) | Notes |
|---|
| 1993 |
1 195 (2 390) km |
Millis, et al.[71](si pas de brume)[72] |
|---|
| 1993 |
1 180 (2 360) km |
Millis, et al. (surface et brume)[72] |
|---|
| 1994 |
1 164 (2 328) km |
Young & Binzel[73] |
|---|
| 1997 |
1 173 ± 23 (2 346 ± 46) km |
Tholen et Buie[74] |
|---|
| 2006 |
1 153 ± 10 (2 306 ± 20) km |
Buie, et al.[75] |
|---|
| 2007 |
1 161 (2 322) km |
Young, Young, & Buie[76] |
|---|
| 2009 |
> 1 169-1 172 (> 2 338-2 344) km |
Lellouch, et al.[77] |
|---|
| 2011 |
1 180 +20/-10 (2 360 +40/-20) km |
Zalucha, et al.[78] |
|---|
| 2011 |
1 173 +20/-10 (2 346 +40/-20) km |
Zalucha, et al.[79] |
|---|
| 2014 |
1 184 ± 4 (2 368 ± 8) km |
Lellouch, et al.[80] |
|---|
| 2015 |
1 185 ± 10 (2 370 ± 20) km |
Mesure de New Horizons[81],[3] |
|---|
| 2017 |
1 188,3 ± 1,6 (2 376,6 ± 3,2) km |
Mesure de New Horizons[82] |
|---|
 La taille de Pluton (en bas à droite) comparée avec celles de Ganymède, Titan, Callisto, Io, la Lune, Europe et Triton.
La taille de Pluton (en bas à droite) comparée avec celles de Ganymède, Titan, Callisto, Io, la Lune, Europe et Triton.
Avant son survol par la sonde New Horizons, le diamètre de Pluton était l'un des paramètres physiques les moins bien connus et les plus difficiles à mesurer, et la source principale d'incertitude sur les autres paramètres dérivés comme la masse volumique. Sa très grande distance combinée à sa petite taille font qu'il est impossible de résoudre avec précision le disque de Pluton, et empêche donc les mesures « directes » de ses dimensions, que ce soit avec le télescope spatial Hubble ou avec les instruments terrestres dotés d'une optique adaptative. Les mesures se fondant sur les occultations d'étoile par Pluton et les occultations de Pluton par Charon ne concordent pas exactement, et les explications permettant d'expliquer ces différences dépendent des modèles utilisés pour analyser les données, notamment concernant l'atmosphère de la planète naine. La valeur et la marge d'erreur généralement retenue de 2 306 ± 20 km de diamètre incluent en fait les différences de résultat des différentes méthodes de mesure[83]. Le , la sonde New Horizons permet de réévaluer légèrement à la hausse le diamètre de Pluton à 2 370 ± 20 km (soit un rayon de 1 185 ± 10 km[3]), l'incertitude de cette valeur étant due à la présence d'une atmosphère planétaire[3]. En 2017, la ré-analyse des données de New Horizons permet d'affiner ce résultat : 2 376,6 ± 3,2 km (rayon : 1 188,3 ± 1,6 km)[82].
Masse
La masse de Pluton, tout comme son diamètre, ont été largement surestimés durant les décennies suivant sa découverte. Percival Lowell espérait trouver une planète comparable à Neptune, de l'ordre de dix fois la masse terrestre. La magnitude observée étant plus faible que prévu, on abaissa l'évaluation à une masse terrestre[89]. Les estimations qui tablaient sur une taille comprise entre celles de Mercure et de Mars[19] ont continuellement été revues à la baisse avec l'amélioration des instruments d'observation. En 1976, l'analyse de la lumière de Pluton fit supputer une surface glacée, donc un éclat fourni par une surface plus petite, et une masse réduite à un centième de celle de la Terre[89]. La découverte de Charon en 1978 a permis, par application de la troisième loi de Kepler, de déterminer beaucoup plus précisément la masse totale du couple planétaire. La masse de Pluton est estimée en 2006 à 1,314 × 1022 kg[83], soit 5,6 fois moins que celle de la Lune ou le cinq centième de la masse terrestre[90]. En extrapolant cette baisse continuelle, deux astronomes facétieux sont allés jusqu'à annoncer la disparition complète de Pluton[91].
Géographie physique et caractéristiques géologiques
Atmosphère
 Sur cet assemblage de photographies prises par la sonde New Horizons on voit la lumière du soleil diffusée par différentes couches de brume de l'atmosphère de Pluton. Les couleurs, rajoutées à l'aide d'une autre photographie, sont proches de la réalité. Les montagnes et d'autres caractéristiques topographiques se détachent en ombres chinoises sur le bord de la planète naine.
Sur cet assemblage de photographies prises par la sonde New Horizons on voit la lumière du soleil diffusée par différentes couches de brume de l'atmosphère de Pluton. Les couleurs, rajoutées à l'aide d'une autre photographie, sont proches de la réalité. Les montagnes et d'autres caractéristiques topographiques se détachent en ombres chinoises sur le bord de la planète naine.
Pluton ne possède pas d'atmosphère significative. Mais d'après les lois de la physique, les glaces de sa surface doivent être en équilibre thermodynamique avec des phases gazeuses, elle serait donc entourée d'une mince enveloppe de gaz qui serait composée d'azote (N2) à 90%, car c'est l'élément le plus volatil parmi ceux détectés à la surface, et de monoxyde de carbone (CO) à 10 %, ainsi que des traces de méthane (CH4)[92]. En outre, les scientifiques de la mission New Horizons ont noté que cette atmosphère s'échappe à un rythme d'environ 500 tonnes par heure à cause de la faible attraction gravitationnelle de la planète naine[93].
L'atmosphère de Pluton a été découverte lors d'une occultation stellaire en 1985[94], et confirmée par une autre occultation en 1988. Lorsqu'un objet dépourvu d'atmosphère passe devant une étoile, cette étoile d'arrière-plan disparaît de manière brutale ; dans le cas de Pluton, la luminosité de l'étoile masquée a graduellement diminué. De l'évolution de cette courbe de luminosité, une mince atmosphère de 0,15 Pa a été déterminée, soit environ un 700 000e de celle de la Terre. Cette atmosphère pourrait n'exister que lorsque la planète est proche de son périhélie, et geler lorsqu'elle s'éloigne du Soleil. En effet, l'énergie du Soleil reçue par Pluton varie assez fortement entre le périhélie et l'aphélie[95], du fait de son excentricité orbitale marquée. La température change d'environ 10 K entre ces deux points. Lorsque Pluton s'écarte de son périhélie, une partie de son atmosphère gèle et retombe à la surface. Quand elle s'en rapproche, la température de la surface augmente et l'azote se sublime. À la manière de la sueur qui s'évapore sur la peau, cette sublimation tend à refroidir la surface, et des recherches ont montré que la température de Pluton est 10 K inférieure à ce qui était attendu[96] (température moyenne en surface : −228 °C) ; contrairement à Charon qui, sans atmosphère, a une température de surface conforme à son albédo.
En 2002, une autre occultation stellaire par Pluton a été observée par plusieurs équipes dirigées par Bruno Sicardy[97], Jim Elliot[98] et Jay Pasachoff[99]. De manière surprenante, la pression atmosphérique a été estimée à 0,30 Pa, bien que Pluton soit plus éloignée du Soleil qu'en 1988, et donc plus froide. L'hypothèse privilégiée à l'heure actuelle est que le pôle Sud de Pluton serait sorti de l'ombre en 1987 pour la première fois depuis 120 ans, et qu'un surplus d'azote aurait alors sublimé une partie de la calotte polaire sud. Cet excès d'azote devrait mettre vraisemblablement des décennies avant de se condenser à l'autre pôle, selon un phénomène cyclique[100].
Le survol de Pluton par New Horizons permet une mesure directe de la pression au sol : 11 µbar[101] (1,1 Pa), 100 000 fois moins que sur Terre mais trois fois plus que l'estimation précédente la plus élevée. Cette atmosphère s'échappe 500 à 1 000 fois moins vite qu'il n'était prévu, et elle a une présence significative jusqu'à plusieurs centaines de kilomètres d'altitude, avec des dizaines de couches de brume mais pas de nuages. Le 8 octobre 2015, la NASA annonce que, vu depuis Pluton, le ciel paraît bleu du fait de la diffusion de la lumière par des particules (qui seraient pour leur part plutôt grises ou rouges), ressemblant à de la suie, appelées tholines[102].
Albédo et surface
 Distribution de la glace de méthane à la surface de Pluton, le 12 juillet 2015 (reçue le 15 juillet 2015). En rouge, en bleu et en vert des zones de compositions différentes : la glace de méthane est diluée avec de la glace d'azote au pôle nord.
Distribution de la glace de méthane à la surface de Pluton, le 12 juillet 2015 (reçue le 15 juillet 2015). En rouge, en bleu et en vert des zones de compositions différentes : la glace de méthane est diluée avec de la glace d'azote au pôle nord.
 Un petit morceau de la surface de Pluton vue par New Horizons le 14 juillet 2015. La barre jaune qui sert d'échelle représente 80,5 kilomètres (ou 50 miles). Des montagnes d'environ 3 500 m sont visibles et la surface semble récente à la vue de l'absence de cratères[103].
Un petit morceau de la surface de Pluton vue par New Horizons le 14 juillet 2015. La barre jaune qui sert d'échelle représente 80,5 kilomètres (ou 50 miles). Des montagnes d'environ 3 500 m sont visibles et la surface semble récente à la vue de l'absence de cratères[103].
Les variations de luminosité de Pluton témoignent d'une inégale brillance entre les différentes régions à sa surface. Pluton réfléchit la lumière solaire avec un albédo de 58 % en moyenne, ce qui est une valeur élevée (elle est de 31 % pour la Terre, et monte à 72 % pour Vénus grâce à sa couche nuageuse). Le pôle Nord est particulièrement brillant, avec un albédo estimé à 80 %, le pôle Sud est un peu moins lumineux, tandis que l'équateur présente une bande sombre 5 fois moins réfléchissante, et les zones intermédiaires des contrastes marqués. Les zones d'albédo élevé sont interprétées comme des parties couvertes de neige ou de glace de formation récente, non encore obscurcie par des dépôts d'impuretés, tandis que les parties sombres pourraient être des composés carbonés. La cartographie de ces zones a été affinée par l'analyse des variations lumineuses lors des passages de Charon devant Pluton, et confirmée en 1994 par les observations directes de Hubble[104]. L'image d'ensemble, prise grâce à la caméra pour objets à luminosité réduite (Faint Object Camera), demeure toutefois très floue, car elle n'est constituée que d'une centaine de pixels, mesurant chacun 200 km de côté[105]. Un nouvel équipement de Hubble, l'Advanced Camera for Surveys, fournit en 2002-2003 des vues complètes de Pluton, encore floues mais montrant des modifications de coloration par rapport aux précédentes images[49].
 Image de la plaine Spoutnik, vaste étendue de glace située dans le centre gauche de la région Tombaugh (le contexte)[106],[107].
Image de la plaine Spoutnik, vaste étendue de glace située dans le centre gauche de la région Tombaugh (le contexte)[106],[107].
Les analyses par spectroscopie infrarouge ont identifié plusieurs types de glace à la surface de Pluton : glace de méthane en 1976, puis à partir de 1992, glace d'azote, la plus abondante avec une proportion de l'ordre de 98 %, glace de monoxyde de carbone, glace d'eau et glace d'éthane. La température moyenne au sol est évaluée à −223 °C, avec des variations selon les zones, −213 °C pour les zones sombres et entre −238 °C et −233 °C pour les parties les plus réfléchissantes[108].
Sur sa surface, de la glace de méthane (CH4) et d'azote (N2) a été détectée aux pôles par une observation dans l'infrarouge[109], en calottes dont la taille varie selon l'éloignement de la planète par rapport au Soleil. À la date du 5 février 2010, certains spécialistes ont remarqué que la glace au pôle Nord est devenue plus brillante, alors que celle du pôle Sud s'est assombrie. Sous la croûte plutonienne se trouve vraisemblablement un manteau glacé[110].
Au cours des dernières années, la couleur de Pluton a pris une teinte rouge de 20 à 30 % plus élevée qu'en 2000, alors qu'elle n'avait pas changé de toute la période allant de 1954 à 2000. Ce changement de teinte serait dû au méthane, composé présent sur la planète naine. L'hydrogène contenu dans le méthane, frappé par des vents solaires, libérerait le carbone constituant l'autre partie du méthane, produisant des teintes de rouge et de noir à la surface de Pluton[111].
Les photographies du 26 et 27 juin 2015 prises par New Horizons montrent « une série de taches intrigantes au niveau de l'équateur, régulièrement espacées. Chacune de ces taches fait environ 480 km de diamètre »[112]. Le 8 octobre 2015, la NASA annonce la détection de glace d'eau à la surface de Pluton par New Horizons[102].
 Cthulhu, alias la « baleine » (zone sombre en bas à gauche de l'image) et la région Tombaugh, alias le « cœur », à sa droite.
Cthulhu, alias la « baleine » (zone sombre en bas à gauche de l'image) et la région Tombaugh, alias le « cœur », à sa droite.
 Image montrant des affleurements de glace d'eau (en bleu), en bordure du lobe gauche de la région Tombaugh.
Image montrant des affleurements de glace d'eau (en bleu), en bordure du lobe gauche de la région Tombaugh.
 Concentration en eau à la surface de Pluton : la région Lowell et la plaine Spoutnik contiennent peu ou pas d'eau en surface et ne sont donc pas colorés.
Concentration en eau à la surface de Pluton : la région Lowell et la plaine Spoutnik contiennent peu ou pas d'eau en surface et ne sont donc pas colorés.
Géographie
Le survol de Pluton par la sonde New Horizons a révélé une géographie et une géologie bien plus diversifiées qu'on ne s'y attendait[101] : vastes glaciers d'azote (800 000 km2 pour Sputnik Planitia, le plus grand d'entre eux), terrains chaotiques et montagneux provenant du démantèlement d'anciens glaciers, blocs de méthane gelé et calottes de neige de méthane, un ensemble de tours de glace de méthane (de plus de 300 m de hauteur) long de centaines de kilomètres, et des systèmes de failles s'étendant également sur des centaines de kilomètres.
- La densité surfacique des cratères d'impact à la surface de Pluton est extrêmement variable d'une région à l'autre, ce qui traduit des âges très variés : depuis moins de 30 millions d'années pour la plaine Spoutnik jusqu'à plus de 4 milliards, en passant par des zones d'âge moyen (entre 100 millions et un milliard).
- De nombreux volcans de glace sont également présents, d'âge relativement faible (100 à 300 millions d'années).
- En plus des cratères d'impact et des cratères volcaniques, on dénombre des milliers de cratères (jusqu'à 10 km de diamètre) d'origine incertaine mais plausiblement liée à la sublimation de la glace d'azote.
Plusieurs grandes régions ou caractéristiques géologiques sont connues à ce jour :
- la région Tombaugh, surnommée le « Cœur », grande zone claire[113] de plus de 2 000 km de large. Le lobe ouest du cœur est recouvert de glace de monoxyde de carbone[114]. Ce lobe comprend la plaine Spoutnik au nord-est, les monts Hillary à l'ouest, et les monts Tenzing au sud ;
- la macule Cthulhu, surnommée « la Baleine », grande zone sombre de plus de 3 000 km de long au niveau de l'équateur, donc plus de 40 % de la circonférence de Pluton, possiblement recouverte de glaces moins volatiles que celle d'azote, comme celle de méthane ;
- Krun, Ala, Balrog, autres régions sombres ;
- la région polaire, de luminosité intermédiaire ;
- une structure polygonale mesurant environ 200 km dans sa plus grande dimension ;
- une bande de terrain relativement complexe parcourant diagonalement la planète naine.
 Carte de la planète naine, centrée sur le « cœur ».
Carte de la planète naine, centrée sur le « cœur ».
Cryovolcanisme
 Le mont Wright (au centre).
Le mont Wright (au centre).
L'existence de cryovolcanisme sur Pluton est envisagée. Ainsi, deux structures géologiques à sa surface, le mont Piccard et le mont Wright, sont approximativement circulaires avec une dépression en leur centre[115] et pourraient être deux cryovolcans[116],[117]. Le 29 mars 2022, les scientifiques confirment que des volcans de glace ont bien été reconnus grâce à des images captées par la sonde New Horizons de la NASA. D’après les scientifiques, il est très probable que ces volcans de glace soient encore actifs (Kelsi Singer - Southwest Research Institute - Boulder, Colorado)[1] [archive][2] [archive]
Composition interne
 Structure interne hypothétique de Pluton :
Structure interne hypothétique de Pluton :
1 - Azote gelé.
2 - Glace d'eau.
3 - Noyau rocheux.
La composition interne de Pluton est pour l'instant inconnue. S'il y a eu différenciation planétaire, il pourrait y avoir un noyau rocheux. Si l'on accorde à Pluton une densité de 2, valeur approximative, la densité voisine de 1 des glaces détectées en surface doit être compensée par une masse rocheuse, de densité de l'ordre de 4 ou 5, en proportion égale aux glaces d'eau et d'éléments volatils (azote, méthane, oxyde de carbone). Ces roches pourraient affleurer à la surface sans être visibles car dépourvues de signatures spectrales caractéristiques, ou bien être recouvertes d'un manteau de glaces[118].
Avec une teneur en glace d'eau de l'ordre de 50 % ou plus pour la masse de Pluton, la présence en profondeur d'eau liquide sous l'effet de la haute pression est envisageable dans les couches profondes, coexistant avec de la glace sous haute pression[119]. Des simulations basées sur les données de la sonde New Horizons concernant la plaine Spoutnik ont renforcé la présomption de l'existence d'un océan interne d'une profondeur d'une centaine de kilomètres[120]. Pour expliquer que Pluton puisse maintenir un océan sous-marin tout en possédant une couche externe de glace très froide, il a été avancé qu'il y a probablement une couche isolante de clathrates au-dessus de l'océan interne, qui est supposé être constitué d'eau et de méthane[121].
Système plutonien
Le système plutonien, le 9 juillet 2012.
modifier 
Description
Les recherches d'un satellite de Pluton partaient du postulat qu'un éventuel satellite devait être beaucoup plus petit que sa planète, comme c'est le cas dans le reste du Système solaire, et donc moins lumineux que Pluton. Des clichés réalisés dans les années 1950 et 1960 très surexposés par des temps de pose longs ne donnèrent aucun résultat. La théorie de Gerard Kuiper qui proposait de voir en Pluton un ancien satellite de Neptune éjecté de son orbite, impliquait que Pluton ne pouvait probablement pas avoir de lune, ce qui n'incitait pas à sa recherche. La découverte d'un satellite près de 50 ans après celle de Pluton fut donc fortuite[123].
Pluton possède cinq satellites naturels connus, le plus grand étant Charon qui fut identifié dès 1978. Deux satellites plus petits ont été découverts en 2005 et nommés Hydre et Nix (connus jusqu'en par leurs désignations provisoires S/2005 P 1 et S/2005 P 2)[124]. Le cinquième membre du système, nommé provisoirement S/2011 (134340) 1 et informellement P4, fut découvert en 2011. La découverte d'un dernier satellite, provisoirement connu comme S/2012 (134340) 1 et informellement surnommé P5, est annoncée le [125]. La sonde New Horizons ne détecte aucun autre satellite de plus d'1,7 kilomètre de diamètre pour un albédo de 0,5 lors de son passage dans le système plutonien[126].
Le , l'Institut SETI lance la campagne Pluto Rocks! qui permet aux internautes de voter pour les noms qu'ils préféreraient voir attribués à P4 et P5. Le site permettait aussi de proposer des noms tant qu'ils respectent les règles de l'Union astronomique internationale[127]. La campagne se termine après avoir recueilli près de 450 000 votes. Le nom le plus populaire est Vulcain, proposé par l'ancien acteur de Star Trek, William Shatner, suivi de Cerberus. Cependant, d'autres objets portant déjà ces noms et pour éviter toute confusion, l'orthographe grecque Kerberos est préférée à sa version latine Cerberus, et Styx, troisième du classement, est préféré à Vulcain. Le , l'Union astronomique internationale confirme les noms de Kerbéros pour P4 et Styx pour P5[128].
Une particularité du système plutonien est que le barycentre du couple Pluton/Charon n'est pas situé à l'intérieur du premier mais dans le vide entre les deux corps[129].
La distribution des satellites de Pluton est concentrée au centre du système. Potentiellement, un satellite pourrait orbiter autour de Pluton jusqu'à 53 % du rayon de sa sphère de Hill (soit environ 6 × 106 km) dans le sens direct et 69 % dans le sens rétrograde, mais le système plutonien est resserré dans les 3 % internes de cette zone. À titre de comparaison, Psamathée orbite Neptune à 40 % du rayon de sa sphère de Hill. Selon les termes des découvreurs de Nix et Hydre, le système plutonien est « hautement compact et largement vide »[130].
Charon
 Modélisation de la révolution de Pluton et de Charon autour d'un barycentre commun, à l'extérieur des deux corps. On y peut observer la synchronicité des rotations.
Modélisation de la révolution de Pluton et de Charon autour d'un barycentre commun, à l'extérieur des deux corps. On y peut observer la synchronicité des rotations.
Charon fut découvert en 1978[131], lors d'une campagne d'astrométrie destinée à affiner la mesure de position de Pluton. James Christy remarqua sur la tache lumineuse des clichés de Pluton une excroissance placée différemment selon les clichés, dont l'examen révéla une périodicité d'une semaine. Christy annonça sa découverte le 7 juillet 1978 et proposa de la nommer Charon[123].
Comparativement à Pluton, Charon est un très gros satellite (son rayon de 600 km environ est la moitié de celui de Pluton, estimé à 1 170 km), et le barycentre des deux corps se trouve au-delà de la surface de Pluton (à un peu plus de deux rayons plutoniens). Il s'agit du plus grand système de ce genre dans le Système solaire (certains astéroïdes binaires possèdent également ce trait, comme (617) Patrocle ; le barycentre du Soleil et de Jupiter est également situé à l'extérieur du premier) et il y est parfois fait référence comme un système binaire d'astéroïdes[123].
Sous l'effet de marée gravitationnelle, Pluton et Charon sont tous les deux en rotation synchrone, avec une période de 6,387 jours : Charon présente toujours la même face à Pluton et Pluton la même face à Charon, un fait inhabituel dans le Système solaire pour deux objets de cette taille (mais non exceptionnel, certains astéroïdes binaires possèdent cette propriété)[123].
La découverte de Charon a permis en exploitant de 1985 à 1990 les occultations de Charon par Pluton et les transits de Charon devant Pluton de préciser la masse totale du système double et de déterminer que celle-ci était inférieure aux estimations précédentes. En fait, elle a amené les astronomes à revoir totalement leur estimation de la taille de Pluton. À l'origine, on pensait que Pluton était plus grande que Mercure (on lui donnait environ 6 800 km de diamètre) et plus petite que Mars, mais les calculs étaient fondés sur le fait qu'un seul objet était observé (on ne distinguait pas Charon de Pluton). Une fois le système double découvert, l'estimation de la taille de Pluton a été revue à la baisse. Il est possible aujourd'hui, avec des instruments modernes, de distinguer le disque de Pluton séparément de celui de Charon (voir l'image établie par Hubble en 2006)[123].
En conséquence, l'albédo de Pluton a dû aussi être recalculé et revu à la hausse : la planète étant bien plus petite que les premières estimations, sa capacité à réfléchir la lumière devait être plus importante que ce que l'on pensait. Les estimations actuelles lui donnent une valeur moyenne de 58 %, tandis que Charon avec 36 % apparaît beaucoup plus sombre. Charon n'a pas retenu le méthane, seule de la glace d'eau et d'ammoniac y a été détectée[110].
Les observations faites par la sonde New Horizons en juillet 2015 ont permis de découvrir une zone sombre au nord de ce satellite, surnommée « Mordor » par l'équipe de la NASA[132].
Hydre et Nix
 Pluton et trois de ses cinq satellites connus, vus par Hubble le 15 février 2006.
Pluton et trois de ses cinq satellites connus, vus par Hubble le 15 février 2006.
Pluton possède deux autres satellites, qui furent photographiés le lors d'une campagne d'observation du télescope spatial Hubble, temporairement nommés S/2005 P 1 et S/2005 P 2 puis dénommés Hydre (du nom du monstre l'Hydre) et Nix (de Nyx, mère de Charon)[133]. Ils ont été repérés par une équipe du Southwest Research Institute sur des clichés pris pour préparer la nouvelle mission d'exploration lointaine du Système solaire, New Horizons. Leur existence fut confirmée par l'examen de photographies prises par Hubble et datant du [124].
 Photographie du satellite Hydre.
Photographie du satellite Hydre.
D'après les premières observations, le demi-grand axe de l'orbite de Nix mesure 49 000 km avec une période de 24,9 jours et celui de l'orbite d'Hydre 65 000 km avec une période de 38,2 jours. Les deux satellites semblent orbiter dans le sens rétrograde dans le même plan que Charon et sont deux et trois fois plus éloignés que celui-ci, avec une résonance orbitale proche de (mais pas égale à) 4:1 et 6:1[124].
Les observations se poursuivent pour déterminer les caractéristiques des deux astres. Hydre est parfois plus brillant que Nix, soit parce qu'il est plus grand, soit parce que la luminosité de sa surface varie suivant les zones. Le spectre des satellites est similaire à celui de Charon, ce qui suggère un albédo similaire d'environ 0,35 ; dans ce cas, le diamètre de Nix est estimé à 46 km et celui de Hydre à 61 km. Une limite supérieure peut être déterminée en supposant un albédo de 0,04 similaire aux objets les plus sombres de la ceinture de Kuiper : 137 ± 11 km pour Nix et 167 ± 10 km pour Hydre. Dans ce cas, la masse des satellites serait 0,3 % de celle de Charon (0,03 % de la masse de Pluton)[134].
Autres objets orbitant autour de Pluton
 Schéma des orbites du système plutonien. S/2011 (134340) 1 (indiqué par P4) orbite entre les lunes Nix et Hydre.
Schéma des orbites du système plutonien. S/2011 (134340) 1 (indiqué par P4) orbite entre les lunes Nix et Hydre.
Pluton possède un quasi-satellite nommée (15810) Arawn.
Les observations effectuées par le télescope spatial Hubble ont placé des limites quant à l'existence de satellites additionnels dans le système plutonien. Avec une probabilité de 90 %, aucune lune de plus de 12 km et d'un albédo similaire à celui de Charon (soit 0,38) n'existe dans une zone de 5" autour de Pluton. Pour un albédo plus sombre de 0,041, cette limite est portée à 37 km. Avec une probabilité de 50 %, cette limite descend à 8 km[135].
Dans un article publié dans la revue Nature[130], une équipe de scientifiques américains conduite par S. A. Stern (du Southwest Research Institute) a annoncé que Nix et Hydre se sont très probablement formées lors du même impact géant qui a donné naissance à Charon. L'équipe a émis l'hypothèse que d'autres grands objets binaires de la ceinture de Kuiper pourraient également abriter de petites lunes et que celles qui gravitent autour de Pluton pourraient générer des anneaux de débris autour de la planète naine. À l'heure actuelle, les données provenant de la caméra de prospection avancée d'Hubble suggèrent qu'aucun anneau n'existe. Dans le cas contraire, il s'agit d'un anneau ténu comme ceux de Jupiter ou de moins de 1 000 km de large[136].
Lors d'une nouvelle campagne d'observation réalisée à l'aide du télescope spatial Hubble, une nouvelle lune fut observée, le . Cette observation a été confirmée par d'autres le 3 et le 18 juillet. La petite lune nommée Kerberos (quelquefois francisé en Cerbère ; provisoirement S/2011 (134340) 1 ou P4) et dont la taille doit être comprise entre 13 et 34 km, a une orbite inscrite entre celles de Nix et d'Hydre[137].
Une nouvelle lune appelée Styx (provisoirement S/2012 (134340) 1 ou P5), a été découverte entre le 26 juin et le [138], elle fut baptisée par l'Union astronomique internationale, le [139].
Après une première inspection des environs de Pluton les 11 et , lors de laquelle l'instrument LORRI de la sonde New Horizons a pris 144 photos de 10 minutes chacune afin de repérer tout objet qui pourrait être dangereux pour la sonde lors de sa traversée du système plutonien, aucun nouveau satellite n'a été repéré. S'ils existent, les satellites supplémentaires de Pluton ont donc une taille maximale de 5-15 kilomètres (intervalle correspondant à différents albédos). De même, aucun anneau de matière n'a été repéré, ce qui signifie que, s'ils existent au-delà de l'orbite de Charon, ils sont soit extrêmement fins — moins de 1 000 km de large — soit extrêmement peu réflectifs (ils réfléchiraient moins d'un cinq-millionième de la lumière solaire incidente).
Théories sur l'origine du système plutonien
 Scénario possible de la formation de Charon par collision.
Scénario possible de la formation de Charon par collision.
Différentes théories ont été formulées pour expliquer l'origine du système plutonien, et notamment la petite taille de Pluton, comparable à celle de satellites de la géante voisine Neptune.
- Le mathématicien britannique Raymond Lyttleton a envisagé en 1936 que Pluton et Triton tournaient ensemble autour de Neptune, et qu'une perturbation gravitationnelle avait éjecté Pluton hors de l'orbite planétaire, tandis qu'elle replaçait Triton sur une orbite rétrograde[140]. Cette idée eut cours assez longtemps, et Gerard Kuiper l'a reprise en voyant dans Pluton un ancien satellite de Neptune ; Triton semble en outre partager certaines caractéristiques atmosphériques et géologiques avec Pluton. Même si ces points ont été évoqués pour soutenir une origine neptunienne de Pluton, le consensus actuel est que ce dernier n'a jamais fait partie des satellites de Neptune.
- L'orbite rétrograde de Triton laisse penser que celui-ci était à l'origine un objet de la ceinture de Kuiper sur une orbite solaire et qu'il fut capturé par Neptune[141]. Selon le scénario de formation du Système solaire le plus communément admis (modèle de Nice), Pluton et Charon se sont formés par accrétion en même temps que d'autres corps, et ont ensuite été chassés au-delà de l'orbite de Neptune par l'influence gravitationnelle des planètes géantes. Alors qu'une partie de ces corps étaient éjectés aux confins du Système solaire, ceux qui subsistaient forment la ceinture de Kuiper. Les corps qui orbitaient en résonance 2:3 avec Neptune gardaient une orbite stable, parmi ceux-ci Pluton[142]. Le couple Pluton-Charon se serait formé par capture mutuelle lors d'un frôlement ou d'une collision entre ces deux objets, et Nix et Hydre seraient peut-être des vestiges de cette rencontre[143].
- La détermination de la taille et de la densité de Pluton et Charon par la sonde New Horizons permet aujourd'hui de préciser leur composition. En admettant qu'il s'agit d'un mélange de roches (formées par condensation de la nébuleuse solaire) et de glaces, Pluton comporterait environ 2/3 de roches (en masse) et Charon 3/5 : ces deux corps ont des densités plus proches l'une de l'autre[e] que des autres objets de Kuiper de grande taille (≳ 1 000 km de diamètre), tandis que les quatre petits satellites (Hydra, Nix, Kerbéros et Styx) sont beaucoup plus riches en glaces[126]. Ces résultats tendent à privilégier la formation de Pluton et Charon par l'impact, à vitesse modérée, de deux corps précurseurs partiellement différenciés[144]. Cette théorie est compatible avec ce qu'on sait des conditions dynamiques anciennes dans la ceinture de Kuiper, mais implique que les deux corps précurseurs se soient accrétés tardivement[126]. La richesse en glaces des petits satellites n'est pas compatible avec une formation directe du système plutonien par déstabilisation gravitationnelle de la nébuleuse solaire, un mécanisme qui a été proposé pour la formation des objets de Kuiper binaires[145].
Superstitions
Le nom-même attribué à Pluton en tant que maître des Enfers a excité outre mesure l'imagination des astrologues[146] à une époque de temps troublés où l'astrologie a - comme d'habitude pour les périodes de crises[147]- connu une effervescence (à cette époque, elle est sortie de sa clandestinité, faisant irruption dans les médias de masse[148],[149]). Le spécialiste de l'histoire de l'astrologie Jacques Halbronn[f] trouve curieux que le nom choisi par les astronomes ait déterminé le symbolisme adopté par les astrologues[146]. En effet, il y avait dans le nom « Pluton » l'idée du juge des âmes, et dès lors d'une sorte de Jugement Dernier[150]. Quatre ans seulement après la découverte de l'astre, l'astrologue allemand Fritz Brunhübner, voyant en Pluton un astre super-maléfique, a affirmé que « Pluton peut être appelé l'aspect cosmique à l'origine du Troisième Reich »[151],[152]. Avec une absence de recul remarquable pour un astre dont la période de révolution est de 249 ans, Brunhübner est alors allé jusqu'à attribuer à Pluton la maîtrise astrologique sur le signe du Scorpion[153]. Il n'a cependant pas fait consensus : Alexandre Volguine estimait que Pluton gouvernait le signe du Sagittaire[154] alors que Dane Rudhyar voyait l'astre en analogie avec le signe du Bélier[155]. D'autres ont fait l'hypothèse d'une maîtrise astrologique sur le signe des Poissons[156]!
Pluton dans les œuvres de fiction
- En 1922, dans le roman-feuilleton d'anticipation L'Anneau de lumière : grand roman scientifique d'aventures, de L. Miral et A. Viger (pseudonymes du romancier Ernest Jacob 1858-1942 et du vulgarisateur scientifique Alphonse Berget, 1860-1934), épisode no 57 paru dans Le Petit Parisien du 3 janvier 1922 (roman publié en volume sous le titre L'Anneau de feu, Hachette, 1922, p. 275), on nomme Pluton la planète transneptunienne à découvrir (découverte dans le récit par les astronomes de la planète Mars, qui la nomment "Zooh" dans leur langue) : "Cette planète inconnue, soupçonnée, pressentie par Le Verrier qui sans l'apercevoir lui avait donné le nom de Pluton, cette planète était là, sous leurs yeux. Son image, faible mais nette, se projetait sur un écran" [Le Verrier ne semble pas avoir nommé cette planète encore inconnue Pluton ; ce nom semble avoir été donné pour la première fois à cet astre en 1897, par un astrologue, Fomalhaut (pseudonyme de Charles Nicoullaud, 1854-1923), dans son Manuel d'astrologie sphérique et judiciaire (Vigot, 1897)]. Plus étonnant, le récit de Miral et Viger affirme que Pluton possède un gros satellite : "Et autour de sa masse, on voyait graviter un satellite unique mais énorme, un satellite gros comme le quart de la planète elle-même", curieuse prescience de Charon. Voir https://gallica.bnf.fr/ark:/12148/bpt6k6048876/f2.item.zoom [archive]
- En 1930, dans la nouvelle Celui qui chuchotait dans les ténèbres, H. P. Lovecraft met en scène des créatures venant d'une planète nommée Yuggoth et récemment découverte par les humains, c'est-à-dire Pluton.
- En 1931, dans le film La Chasse à l'élan, Walt Disney baptise un de ses personnages de films d'animation en l'honneur de la planète récemment découverte. C'est le chien Pluto.
- En 1962, dans la bande dessinée Le Piège diabolique, Edgar P. Jacobs situe sur la planète Pluton la base de la résistance armée contre la dictature terrienne du LIe siècle.
- Dans les années 1970, une série d'histoires courtes en BD publiées dans le journal Spirou sous la signature de Gelem (Gérard Lemaire), met en scène un personnage et son voisin nommé Harry Kô aux prises avec des extra-terrestres venus notamment de Mercure, de Saturne et de Pluton.
- En 1974, dans le roman La Guerre éternelle de Joe Haldeman, l'entraînement initial des soldats se situe sur Charon, satellite principal de Pluton.
- Dans les années 2010, dans la série Rick et Morty, le peuple de Pluton est terrifié à l'idée de perdre son statut de planète. La diminution du diamètre de Pluton est expliquée par l'exploitation minière du cœur de la planète.
- En novembre 2014, dans la vidéo WHAT THE CUT #35 Antoine Daniel, des chameaux venant de Pluton attaquent la Terre et sont vaincus par une alliance de Terriens et des Pirates de l'espace (sauf le Pérou)[157].
- En 2017, dans le roman court Les Agents de Dreamland, Caitlín R. Kiernan utilise l'approche de Pluton par la sonde New Horizons comme un des deux éléments centraux de son intrigue faisant en quelque sorte suite à Celui qui chuchotait dans les ténèbres.
Pluton dans la musique
- The Creatures, le second groupe de Siouxsie Sioux, sort en 1989 l'album Boomerang. La 7e chanson intitulée Pluto Drive invite l'auditeur à venir faire un tour sur Pluton, vantant à la fois son atmosphère claire, sa température froide et ses océans de méthane. Le rythme binaire et lancinant peut éventuellement évoquer le couple Pluton-Charon dans son mouvement continuel.
Notes et références
Notes
- Connu jusqu'en 2006 sous la désignation 2003 UB313, et parfois désigné par les médias sous le nom de Xéna avant qu'il ne reçoive son nom définitif.
- « Comme la plupart des planétologue que je connais, je persiste à utiliser le terme de planète pour Pluton dans mes articles de recherches et à l'oral ; autrement dit, je ne tiens pas compte de la définition de l'Union astronomique internationale, qui conduit à exclure Pluton de la liste des planètes, pour en faire une planète naine ». dans Alan Stern, « Les faces cachées de Pluton », Pour la Science, janvier 2018, no 483, p. 44.
- Les observations du télescope spatial Hubble ont été faites dans deux longueurs d'onde, ce qui est insuffisant pour obtenir directement une image en vraies couleurs. Les cartes de la surface à chacune de ces longueurs d'onde limitent le spectre réel que pourraient produire les matériaux en surface de Pluton. Ces spectres, générés pour chaque point résolu à la surface, sont ensuite convertis en couleurs RVB vues ici. Voir Buie et al., 2010.
- Aux légères variations dues à l'excentricité près, voir libration.
- Au vu des incertitudes, et même en tenant compte de l'existence possible d'un océan sous la croûte de glace de Pluton (mais pas dans Charon) ainsi que de la plus grande porosité de la croûte de Charon, les deux compositions globales sont proches mais significativement distinctes.
Références
Voir aussi
Sur les autres projets Wikimedia :
Bibliographie
 : document utilisé comme source pour la rédaction de cet article.
: document utilisé comme source pour la rédaction de cet article.
Articles connexes
Liens externes
-
- Bases de données astronomiques : (en) AstDyS-2 [archive] • (en) Caractéristiques et simulation d'orbite de 134340 [archive] dans la JPL Small-Body Database.
- « Caractéristiques de Pluton sur le site de l'IMCCE [archive] ».
- (en) Les dernières photos de Hubble publiées en février 2010 [archive].
- « Pluton [archive] » par Astrofiles.
- « "La revanche de Pluton", La Méthode Scientifique, France Culture, 11 juin 2019 [archive] »
- "Pluton, vers de nouveaux horizons ", Le Temps d'un Bivouac, France Inter, 8 aout 2019 [archive]
- (fr + en) « A Plutonian Landscape [archive] », sur Astronomy Picture of the Day, NASA, ¸18/05/2025 (consulté le ) (traduction/adaptation française [archive])
- (fr + en) « Pluto Flyover from New Horizons [archive] », sur Astronomy Picture of the Day, NASA, ¸18/05/2025 (consulté le ) (traduction/adaptation française [archive])
- (fr + en) « Pluto Flyover from New Horizons [archive] », sur Astronomy Picture of the Day, NASA, ¸19/05/2025 (consulté le ) (traduction/adaptation française [archive])
- (fr + en) « Pluto at Night [archive] », sur Astronomy Picture of the Day, NASA, (consulté le ) traduction/adaptation française [archive])

|
| Carte de Pluton. Cliquez sur une région pour afficher son article. |
Plutonium
| Plutonium |
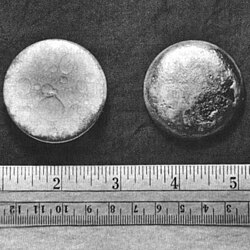
Pastilles de plutonium. |
| |
|
|
| Position dans le tableau périodique |
|---|
| Symbole |
Pu |
|---|
| Nom |
Plutonium |
|---|
| Numéro atomique |
94 |
|---|
| Groupe |
– |
|---|
| Période |
7e période |
|---|
| Bloc |
Bloc f |
|---|
| Famille d'éléments |
Actinide |
|---|
| Configuration électronique |
[Rn] 5f6 7s2 |
|---|
| Électrons par niveau d’énergie |
2, 8, 18, 32, 24, 8, 2 |
|---|
| Propriétés atomiques de l'élément |
|---|
| Masse atomique |
[244] |
|---|
| Rayon atomique (calc) |
159 pm |
|---|
| Rayon de covalence |
187 ± 1 pm[1] |
|---|
| État d’oxydation |
+3, +4, +5, +6, +7 |
|---|
| Électronégativité (Pauling) |
1,28 |
|---|
| Oxyde |
Amphotère |
|---|
| Énergies d’ionisation[2] |
|---|
| |
| 1re : 6,026 0 eV |
2e : 11,2 eV |
| Isotopes les plus stables |
|---|
| |
|
|
| Propriétés physiques du corps simple |
|---|
| État ordinaire |
solide paramagnétique |
|---|
| Masse volumique |
19,85 g/cm3[3] (239Pu) |
|---|
| Système cristallin |
Monoclinique
(no 11 : P21/m) |
|---|
| Couleur |
Blanc argenté ternissant à l'air libre |
|---|
| Point de fusion |
640 °C[4] |
|---|
| Point d’ébullition |
3 228 °C[4] |
|---|
| Enthalpie de fusion |
2,84 kJ/mol |
|---|
| Enthalpie de vaporisation |
344 kJ/mol |
|---|
| Volume molaire |
12,29 × 10−6 m3/mol |
|---|
| Pression de vapeur |
1 Pa
(à 1 483 °C) |
|---|
| Vitesse du son |
2 260 m/s à 20 °C |
|---|
| Chaleur massique |
35,5 J/kg/K |
|---|
| Conductivité électrique |
0,685 × 106 S/m |
|---|
| Conductivité thermique |
6,74 W/m/K |
|---|
| Divers |
|---|
| No CAS |
7440-07-5 |
|---|
| No ECHA |
100.028.288 |
|---|
| No CE |
231-117-7 |
|---|
| Précautions |
|---|

Radioélément à activité notable |
|
| Unités du SI & CNTP, sauf indication contraire. |
modifier  |
Le plutonium est l'élément chimique de symbole Pu et de numéro atomique 94. C'est un métal radioactif transuranien de la famille des actinides. Il se présente sous la forme d'un solide cristallisé dont les surfaces fraîches sont gris argenté mais se couvrent en quelques minutes, en présence d'humidité, d'une couche terne de couleur grise, tirant parfois sur le vert olive, constituée d'oxydes et d'hydrures ; l'accroissement de volume qui en résulte peut atteindre 70 % d'un bloc de plutonium pur, et la substance ainsi formée tend à se désagréger en une poudre pyrophorique.
Le plutonium a été produit et isolé pour la première fois le à l'université de Californie à Berkeley en bombardant de l'uranium 238 par du deutérium. Venant à la suite de l'uranium et du neptunium dans le tableau périodique, ce nouvel élément chimique a été nommé en référence à Pluton, qui vient à la suite des planètes Uranus et Neptune dans le Système solaire. C'est un élément synthétique, produit artificiellement par l'homme, mais on rapporte également l'observation de traces de plutonium naturel dans des minerais d'uranium. Il s'agit d'un métal lourd radiotoxique qui tend à s'accumuler dans les os et, dans une moindre mesure, dans le foie. On observe couramment quatre états d'oxydation du plutonium, de +3 à +6 (l'état +7 est rare), avec des colorations distinctes. La structure électronique du métal pur est déterminée par la bande 5f, qui présente la plus grande densité d'états au niveau de Fermi ; particulièrement étroite, la bande 5f tend à localiser les électrons qui s'y trouvent, de sorte que le plutonium pur à température ambiante est semblable aux matériaux à fermions lourds, avec une capacité thermique et une résistivité électrique élevées.
On connaît pas moins de six allotropes du plutonium à pression atmosphérique, et un septième au-delà de 60 MPa. Ils ont des propriétés bien tranchées et souvent inhabituelles pour un métal. Ainsi, le plutonium α, stable à température ambiante, est l'un des très rares métaux à cristalliser dans le système monoclinique ; ses propriétés physiques et structurelles relèvent davantage des minéraux que des métaux usuels, tandis que ses propriétés mécaniques rappellent celles de la fonte. Le plutonium δ, stable à température plus élevée ou avec une faible fraction molaire de gallium, cristallise en revanche dans une maille cubique à faces centrées, avec une masse volumique inférieure de près de 20 % à celle du plutonium α ; il est davantage métallique, avec des propriétés mécaniques semblables à l'aluminium, mais un coefficient de dilatation thermique négatif (il se contracte en chauffant). Le plutonium est également l'un des rares éléments chimiques dont le liquide est plus dense que le solide au point de fusion. L'existence de multiples allotropes aux énergies internes voisines rend la mise en forme du plutonium particulièrement délicate, au point qu'on utilise plutôt un alliage plutonium-gallium, qui stabilise la phase δ à température ambiante, ce qui facilite l'usinage des pièces en plutonium.
Le plutonium 239 et le plutonium 241 sont des isotopes fissiles par neutrons thermiques, ce qui signifie qu'ils peuvent contribuer à une réaction nucléaire en chaîne et qu'ils peuvent être utilisés dans la conception d'armes nucléaires et de réacteurs nucléaires. Le plutonium 240 présente un taux de fission spontanée très élevé qui impose d'en maintenir un taux inférieur à 7 % dans le plutonium de qualité militaire. Le plutonium 238 a une demi-vie de 88 ans et émet des particules α ; c'est une source de chaleur souvent utilisée par les générateurs thermoélectriques à radioisotopes pour alimenter certaines sondes spatiales en électricité. La séparation des isotopes du plutonium est difficile et ils sont généralement produits spécifiquement par des réacteurs spécialisés. La production de plutonium en quantité suffisante a été l'un des objectifs du projet Manhattan au cours de la Seconde Guerre mondiale afin de développer les premières bombes nucléaires. La première explosion atomique, l'essai Trinity, a utilisé une charge en plutonium, de même que Fat Man, la bombe atomique larguée sur Nagasaki ; la bombe Little Boy larguée trois jours plus tôt sur Hiroshima avait quant à elle un cœur en uranium enrichi.
Propriétés
Physique
Le plutonium est un métal de la famille des actinides présentant, comme la plupart des autres métaux, un aspect argenté brillant comme le nickel. Cependant, au contact de l'air, il se recouvre rapidement d'une couche terne grisâtre, avec des couleurs pouvant tirer sur le jaune ou le vert olive, cette dernière teinte provenant du dioxyde de plutonium[6] PuO2.
Comme le neptunium et l'uranium — et, dans une moindre mesure, le protactinium — la structure électronique du plutonium aux conditions normales de température et de pression est déterminée par les orbitales 5f, qui contribuent de manière prépondérante aux liaisons interatomiques. Les distances entre atomes s'en trouvent réduites dans ces matériaux, qui présentent de ce fait une masse volumique particulièrement élevée : celle du plutonium vaut 19,816 g/cm3, plus du double de celle de l'einsteinium (8,84 g/cm3), qui a pourtant une masse atomique supérieure. Or les distances interatomiques dans un cristal influencent la largeur des bandes électroniques : plus ces distances sont petites, plus les bandes sont étroites. La bande 5f étant mathématiquement moins large que les bandes 6d et 7s, elle devient ici suffisamment étroite pour tendre à localiser les électrons dans le cristal, dont les propriétés métalliques sont par conséquent fortement dégradées[7]. De là provient toute la complexité du plutonium : compte tenu de la structure de bandes très particulière du matériau, où les bandes 5f et 6d ont des niveaux d'énergie très voisins, les électrons 5f du plutonium sont à la limite entre état localisé et état délocalisé dans le cristal, de sorte qu'une légère variation d'énergie interne suffit pour passer de l'un à l'autre, ce qui se traduit par des modifications brutales des propriétés macroscopiques du matériau.
Conséquence de l'influence des électrons 5f, les cristaux des actinides légers sont moins symétriques que ceux des métaux usuels, car les orbitales 5f sont très directionnelles[8], et contraignent la géométrie des cristaux. Le protactinium cristallise dans le système quadratique, moins symétrique que ceux des métaux usuels, tandis que l'uranium et le neptunium cristallisent dans le système orthorhombique, encore moins symétrique, et que le plutonium cristallise dans le système monoclinique, le moins symétrique de tous. Il s'ensuit que le plutonium à l'état standard est peu ductile, peu malléable, peu plastique, et est au contraire plutôt dur et fragile ; on compare souvent ses propriétés mécaniques à celles de la fonte grise[9].
Autre conséquence de l'influence des électrons 5f, le plutonium à l'état standard présente une faible conductivité électrique et une faible conductivité thermique, mais une capacité thermique élevée, ce qui l'apparente aux matériaux à fermions lourds[7]. De plus, sa conductivité électrique tend à décroître lorsqu'on refroidit le matériau[10], ce qui est à l'opposé du comportement habituel des métaux. La tendance s'observe jusqu'à 100 K, puis s'inverse pour le plutonium frais ; la résistivité croît cependant avec le temps en raison des dommages au réseau cristallin dus à la radioactivité.
Propriétés comparées du plutonium et d'autres métaux usuels[11]
| Métal | Conductivité
thermique | Résistivité
électrique | Compressibilité | Module
de Young |
|---|
| Plutonium α |
4,2 W/m/K |
1,45 µΩ m |
0,020 GPa−1 |
100 GPa |
|---|
| Plutonium δ (Pu-Ga) |
9,2 W/m/K |
1,00 µΩ m |
0,033 GPa−1 |
42 GPa |
|---|
| Acier inoxydable |
15 W/m/K |
0,7 µΩ m |
0,000 7 GPa−1 |
180 GPa |
|---|
| Aluminium |
222 W/m/K |
0,029 µΩ m |
0,015 GPa-1 |
70 GPa |
|---|
D'une manière générale, la radioactivité désorganise la structure cristalline du plutonium par accumulation de défauts cristallins[8]. Cependant, l'auto-irradiation peut également chauffer suffisamment le matériau pour conduire à un recuit, ce qui contrebalance l'effet précédent pour des températures supérieures à 1 000 K[12].
Isotopes
 Pièce de 5,3 kg de plutonium électro-raffiné à plus de 99,96 % d'environ 11 cm de diamètre destiné à la fabrication d'une tête nucléaire[13]. La géométrie annulaire vise à prévenir les risques d'accident de criticité.
Pièce de 5,3 kg de plutonium électro-raffiné à plus de 99,96 % d'environ 11 cm de diamètre destiné à la fabrication d'une tête nucléaire[13]. La géométrie annulaire vise à prévenir les risques d'accident de criticité.
On connaît une vingtaine d'isotopes du plutonium. Le plutonium 244 présente la demi-vie la plus longue, avec 80,8 millions d'années, suivi par le plutonium 242, avec 373 300 ans, et le plutonium 239, avec 24 110 ans. Tous les autres isotopes du plutonium ont une demi-vie inférieure à 7 000 ans. Le plutonium présente également huit isomères nucléaires, dont la demi-vie est toujours inférieure à une seconde[14].
Les isotopes connus du plutonium ont une masse atomique allant de 228 à 247. Le mode de désintégration privilégié des isotopes plus légers que le plutonium 244 est la fission spontanée et la désintégration α, qui produit essentiellement du neptunium et de l'uranium, ainsi qu'une grande variété de produits de fission. Le mode de désintégration privilégié des isotopes plus lourds que le plutonium 244 est la désintégration β, qui produit essentiellement de l'américium. Le plutonium 241 est l'isotope parent de la série de désintégration du neptunium, qui donne de l'américium 241 par désintégration β[14],[15].
Le plutonium 239 est, avec l'uranium 233 et l'uranium 235, l'un des trois principaux isotopes fissiles utilisés par l'industrie nucléaire ou à des fins militaires. Le plutonium 241 est également fortement fissile, c'est-à-dire qu'il peut fissionner sous l'impact d'un neutron thermique en libérant suffisamment d'autres neutrons pour permettre la fission d'autres atomes et entretenir ainsi une réaction en chaîne ; il est cependant bien plus radioactif que le plutonium 239, et produit, par désintégration β, de l'américium 241, un fort émetteur de particules α indésirables dans les applications habituelles du plutonium. Soumis à des neutrons thermiques, les isotopes 239Pu et 241Pu ont une probabilité d'environ 3⁄4 de fissionner et d'environ 1⁄4 de donner du 240Pu et du 242Pu respectivement, de sorte que le taux de 240Pu dans le plutonium résiduel après une réaction nucléaire est supérieur à celui du plutonium initial.
Sensiblement moins radioactif que la plupart des autres isotopes, le plutonium 239 pur présente cependant un facteur de multiplication keff supérieur à 1, ce qui signifie que ce matériau peut atteindre la masse critique pour peu qu'une quantité suffisante de matière soit rassemblée dans le volume approprié[16]. Au cours de la fission d'un atome, une fraction de l'énergie de liaison nucléaire, qui assure la cohésion du noyau atomique, est libérée sous forme d'énergie électromagnétique et d'énergie cinétique, cette dernière étant rapidement convertie en énergie thermique. La fission d'un kilogramme de plutonium 239 peut produire une explosion équivalente à 21 kt de TNT (88 000 GJ). C'est cette énergie qui est utilisée par les réacteurs nucléaires et les armes nucléaires[15].
La présence de plutonium 240 dans une masse de plutonium 239 limite l'intérêt militaire de celui-ci car cet isotope présente un taux de fission spontanée supérieur de plus de quatre ordres de grandeur à celui du plutonium 239 — environ 440 fissions/s/g, soit plus de 1 000 neutrons/s/g[17] — ce qui dégrade les performances explosives du matériau et accroît les risques d'explosion incontrôlée[18]. Le plutonium est dit de qualité militaire (weapon-grade) lorsqu'il contient moins de 7 % de plutonium 240, et de qualité combustible (fuel-grade) lorsqu'il en contient moins de 19 %. Le plutonium haute qualité (supergrade), contenant moins de 4 % de plutonium 240, est utilisé, en raison de sa plus faible radioactivité, pour les armes nucléaires devant être conservées à proximité immédiate des équipages, dans les sous-marins nucléaires lanceurs d'engins et les divers types de navires de guerre par exemple[19]. Le plutonium 238 n'est pas fissile mais peut facilement être fissionné sous l'effet de neutrons rapides ainsi que d'une radioactivité α[15].
 Chaînes Th-U et U-Pu.
Chaînes Th-U et U-Pu.
Les deux principaux isotopes synthétisés sont le plutonium 238 et le plutonium 239[15]. Le plutonium 239 est produit par capture neutronique puis désintégration β à partir d'uranium 238[20] :
- 1
0n + 238
92U ⟶ 239
92U → 23.5 m i n β − ![{\displaystyle \mathrm {\xrightarrow[{23.5\ min}]{\beta ^{-}}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/f7a91aa1a6ff0b2763a640151dce5797a76165f7) 239
239
93Np → 2.3565 d β − ![{\displaystyle \mathrm {\xrightarrow[{2.3565\ d}]{\beta ^{-}}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/7a21e2d7d99345c4b8953cd85639c4bb6c936aeb) 239
239
94Pu.
Les neutrons issus de la fission de l'uranium 235 sont absorbés par les noyaux d'uranium 238 pour former de l'uranium 239 ; une désintégration β convertit alors un neutron en proton pour former du neptunium 239, converti par une seconde désintégration β en plutonium 239.
Le plutonium 238 est produit par bombardement d'uranium 238 avec des ions de deutérium[21] :
-
Radioactivité
Hormis le plutonium 240, qui présente un fort taux de fission spontanée, et le plutonium 241, qui se désintègre par radioactivité β, la désintégration spontanée des principaux isotopes du plutonium se fait essentiellement par radioactivité α, c'est-à-dire par émission de particules α (He2+) qui se recombinent avec des électrons du métal pour former de l'hélium, tandis que le plutonium est transmuté en uranium. Ainsi, un cœur typique d'arme nucléaire de 5 kg contient 12,5 × 1024 atomes donnant une activité de 11,5 × 1012 Bq (désintégrations par seconde) émettant des particules α, ce qui correspond globalement à une puissance de 9,68 W [22],[23].
-
Modes de désintégration principaux d'isotopes du plutonium[24]
| Isotope | Période
radioactive
| Activité
massique | Mode de
désintégration | Nucléide
fils | Rapport de
branchement | Énergie de
désintégration |
|---|
| 238Pu |
87,76 ans |
6,34 × 1011 Bq/g |
Radioactivité α |
234U |
71,04 % |
5,499 MeV |
|---|
| 28,84 % |
5,457 MeV |
| 239Pu |
24 130 ans |
2,295 × 109 Bq/g |
Radioactivité α |
235U |
73,30 % |
5,156 MeV |
|---|
| 15,10 % |
5,144 MeV |
| 11,45 % |
5,106 MeV |
| 240Pu |
6 567,5 ans |
8,40 × 109 Bq/g |
Radioactivité α |
236U |
72,90 % |
5,168 MeV |
|---|
| 27,00 % |
5,124 MeV |
| 241Pu |
14,29 ans |
3,81 × 1012 Bq/g |
Radioactivité β |
241Am |
99,99 % |
20,81 keV |
|---|
Les radioisotopes du plutonium libèrent une chaleur de désintégration variable selon les isotopes considérés. Cette grandeur est généralement donnée en watts par kilogramme ou en milliwatts par gramme. Elle peut atteindre des valeurs significatives dans les pièces en plutonium de grande taille (par exemple, dans les têtes nucléaires). Tous les isotopes du plutonium libèrent également de faibles rayons γ.
-
Allotropes
 Le plutonium présente six allotropes à pression ambiante : alpha (α), beta (β), gamma (γ), delta (δ), delta prime (δ’) et epsilon (ε)[8].
Le plutonium présente six allotropes à pression ambiante : alpha (α), beta (β), gamma (γ), delta (δ), delta prime (δ’) et epsilon (ε)[8].
Il existe six allotropes du plutonium à pression atmosphérique, et un septième au-delà de 60 MPa[8]. Ces allotropes ont une énergie interne qui varie peu tandis que leurs propriétés physiques varient de façon spectaculaire. La masse volumique du plutonium pur à pression atmosphérique vaut ainsi 19,86 g/cm3 pour le plutonium α à température ambiante, mais seulement 15,92 g/cm3 pour le plutonium δ à 125 °C[26], soit une densité 20 % plus faible, correspondant à un allongement linéaire de plus de 7,6 %. Le plutonium peut ainsi réagir violemment à des changements de pression, de température ou d'environnement chimique, et les transitions de phase peuvent s'accompagner de changements de volume significatifs et brutaux[8].
-
Phases du plutonium à pression atmosphérique[26]
| Phase | Système cristallin | Température de
transition de phase | Masse volumique[a] |
|---|
| α |
Monoclinique simple |
—[b] |
19,86 g/cm3 |
| β |
Monoclinique à bases centrées |
124,5 °C |
17,70 g/cm3 |
| γ |
Orthorhombique à faces centrées |
214,8 °C |
17,14 g/cm3 |
| δ |
Cubique à faces centrées |
320,0 °C |
15,92 g/cm3 |
| δ’ |
Quadratique centré |
462,9 °C |
16,00 g/cm3 |
| ε |
Cubique centré |
482,6 °C |
16,51 g/cm3 |
| Liquide |
~640 °C |
16,65 g/cm3 |
L'existence d'allotropes aussi différents pour des énergies internes aussi voisines rend la mise en forme du plutonium pur particulièrement délicate. Son état standard, la phase α, est monoclinique, faisant du plutonium pur à température ambiante un matériau dur et cassant comme la fonte grise, qui se prête fort peu à l'usinage et est susceptible de connaître de brusques variations de géométrie sous l'effet d'échauffements modérés. En revanche, la phase δ est cubique à faces centrées, comme de nombreux métaux usuels tels que l'aluminium et le nickel, et présente des propriétés mécaniques semblables à celles de l'aluminium. Stable de 320,0 à 462,9 °C pour le plutonium pur, la phase δ peut être stabilisée jusqu'à température ambiante moyennant l'adjonction d'une petite quantité de gallium, d'aluminium, d'américium, de scandium ou de cérium, qui permet d'usiner et de souder des pièces en plutonium[10]. L'alliage plutonium-gallium est fréquemment utilisé à cet effet, car il permet de s'affranchir des transitions de phases non désirées entraînant des distorsions dues à des gonflements ou des contractions localisés dans la pièce. Le silicium, l'indium, le zinc et le zirconium permettent la formation d'une phase δ métastable par refroidissement rapide. L'adjonction de grandes quantités d'hafnium, d'holmium et de thallium permet également de préserver la phase δ jusqu'à la température ambiante. Le neptunium est le seul élément qui stabilise la phase α monoclinique à température plus élevée[8].
L'élasticité de la phase δ est anisotrope, pouvant varier d'un facteur six à sept selon les directions[27].
Dans les armes à fission, l'onde de choc qui comprime le noyau (au-delà de quelques dizaines de kilobars) provoque également une transition de la phase δ vers la forme α, nettement plus dense, ce qui permet d'atteindre plus facilement la criticité[27].
Alliages
Les alliages de plutonium peuvent être obtenus en ajoutant un métal à du plutonium fondu. Si le métal ajouté est suffisamment réducteur, le plutonium peut être apporté sous forme d'oxydes ou d'halogénures. L'alliage plutonium-gallium et l'alliage plutonium-aluminium, qui stabilisent la phase δ du plutonium à température ambiante, sont obtenus en ajoutant du trifluorure de plutonium PuF3 à du gallium ou de l'aluminium fondus, ce qui présente l'avantage d'éviter de manipuler du plutonium métallique, très réactif[28].
- Plutonium-gallium Pu-Ga — Alliage principal utilisé pour la mise en forme, l'usinage et le soudage de pièces en plutonium en évitant les problèmes structurels posés par les transitions de phases α–δ. Il est utilisé principalement pour la réalisation d'armes nucléaires à implosion[29].
- Plutonium-aluminium Pu-Al — Alternative à l'alliage plutonium-gallium, mais tend à interagir avec les particules α en émettant des neutrons, ce qui réduit son intérêt pour réaliser des armes nucléaires. Il peut en revanche être utilisé pour réaliser du combustible nucléaire[30].
- Plutonium-gallium-cobalt PuCoGa5 — Supraconducteur non conventionnel présentant une supraconductivité en dessous de 18,5 K, un ordre de grandeur au-dessus du plus élevé des systèmes à fermions lourds, et avec un courant critique élevé.
- Plutonium-cérium Pu-Ce et plutonium-cérium-cobalt Pu-Ce-Co — Peuvent être utilisés comme combustibles nucléaires.
- Uranium-plutonium U-Pu — Avec environ 15 à 30 % d'atomes de plutonium, cet alliage peut être utilisé comme combustible nucléaire pour surgénérateurs. Il est pyrophorique et très sensible à la corrosion au point de s'enflammer ou de se désintégrer au contact de l'air, ce qui nécessite de l'allier à d'autres constituants. L'addition d'aluminium, de carbone ou de cuivre n'apporte aucune amélioration notable, tandis que le zirconium et le fer améliorent la résistance à la corrosion, mais ne permettent pas d'éviter la désintégration après plusieurs mois d'exposition à l'air. L'addition de titane ou de zirconium élève le point de fusion de l'alliage[31].
- Uranium-plutonium-zirconium U-Pu-Zr — Peut être utilisé comme combustible nucléaire, notamment pour surgénérateurs[32],[33]. Le titane et le zirconium accroissent la résistance à la corrosion, réduisent l'inflammabilité et améliorent la ductilité, la résistance, l'usinabilité et les caractéristiques thermiques. L'alliage uranium-plutonium-molybdène U-Pu-Mo présente la meilleure résistance à la corrosion, mais le titane et le zirconium sont préférés au molybdène en raison de meilleures propriétés physiques[31].
- Thorium-uranium-plutonium Th-U-Pu — Étudié comme possible combustible nucléaire pour surgénérateurs[31].
Chimie
 Couleurs des cations Pu(III), Pu(IV) et Pu(V) dans une solution molaire d'acide perchlorique HClO4, de Pu(VI) dans une solution de perchlorate de sodium NaClO4 à pH = 7, et de Pu(VII) dans 2,5 M de NaOH[34].
Couleurs des cations Pu(III), Pu(IV) et Pu(V) dans une solution molaire d'acide perchlorique HClO4, de Pu(VI) dans une solution de perchlorate de sodium NaClO4 à pH = 7, et de Pu(VII) dans 2,5 M de NaOH[34].
Le plutonium pur à température ambiante présente des surfaces argentées qui ternissent en quelques minutes au contact de l'air[15]. Il présente quatre états d'oxydation courants en solution aqueuse, plus un cinquième plus rare[35] :
- Pu(III), sous forme d'ion Pu3+ (bleu lavande)
- Pu(IV), sous forme d'ion Pu4+ (brun jaune)
- Pu(V), sous forme d'ion PuO2+ (rose pâle)[c]
- Pu(VI), sous forme d'ion PuO22+ (rose orangé)
- Pu(VII), sous forme d'ion PuO53− (vert ; cet ion heptavalent est rare).
Un complexe avec du plutonium à l'état d'oxydation formel +2, le [K(2.2.2-cryptand)][PuIICp″3], où Cp″ = C5H3(SiMe3)2, a également été publié[37].
La couleur des solutions d'ions de plutonium dépend à la fois de l'état d'oxydation et de la nature de l'anion acide[38]. C'est ce dernier qui influence le degré de complexation du plutonium.
Le plutonium métallique est obtenu en faisant réagir du tétrafluorure de plutonium PuF4 avec du baryum, du calcium ou du lithium à 1 200 °C[39]. Il est attaqué par les acides, l'oxygène et la vapeur d'eau, mais pas par les bases. Il se dissout facilement dans l'acide chlorhydrique HCl, l'acide iodhydrique HI et l'acide perchlorique HClO4 concentrés[10]. Le plutonium fondu doit être maintenu sous vide ou sous atmosphère inerte afin d'éviter la réaction avec l'air[10]. À 135 °C, le plutonium métallique s'enflamme à l'air libre, et explose en présence de tétrachlorométhane[40] CCl4.
Le plutonium réagit avec le carbone pour former des carbures de plutonium Pu3C2, PuC1-δ, Pu2C3 et PuC2 ; il réagit avec l'azote N2 pour former un nitrure PuN, et avec le silicium pour former un siliciure PuSi2[35],[40] ; il réagit avec les halogènes X2, où X peut représenter de fluor, le chlore, le brome et l'iode, en donnant des trihalogénures PuX3. Avec le fluor, outre le trifluorure de plutonium PuF3, on observe également du tétrafluorure de plutonium PuF4 ainsi que de l'hexafluorure de plutonium PuF6. Il se forme par ailleurs des oxyhalogénures PuOCl, PuOBr et PuOI.
Les creusets utilisés avec du plutonium doivent être en mesure de supporter les propriétés très réductrices de ce métal. Les métaux réfractaires, tels que le tantale et le tungstène, ainsi que les oxydes, borures, carbures, nitrures et siliciures les plus stables, peuvent convenir. La fusion dans un four à arc électrique peut permettre de produire de petits lingots de plutonium métallique sans avoir besoin d'un creuset[10].
Corrosion
 Pyrophoricité en conditions statiques de morceaux de plutonium[41] (visibles ici rougeoyant au fond d'une boîte métallique).
Pyrophoricité en conditions statiques de morceaux de plutonium[41] (visibles ici rougeoyant au fond d'une boîte métallique).
Le plutonium pur exposé à l'humidité, que ce soit dans l'air ou dans l'argon, se recouvre en quelques minutes d'une couche terne constituée d'un mélange d'oxydes et d'hydrures[26], qui se désagrège en formant une fine poussière volatile dont l'inhalation peut constituer un risque sanitaire sérieux. C'est la raison pour laquelle le plutonium est manipulé dans des boîtes à gants qui préviennent la dispersion atmosphérique de ces poussières.
Plus précisément, le plutonium exposé à l'air sec se recouvre d'une couche de dioxyde de plutonium PuO2 qui assure une passivation remarquable du métal, réduisant la progression de l'oxydation dans le matériau à une valeur aussi faible que 20 pm/h[41]. En revanche, la présence d'humidité introduit des hydrures PuHx, avec 1,9 < x < 3, qui catalysent la corrosion par l'oxygène O2, tandis que l'humidité en l'absence d'oxygène introduit des oxydes intermédiaires comme le sesquioxyde Pu2O3 qui favorisent la corrosion par l'hydrogène. Enfin, l'humidité en présence d'oxygène conduit à l'oxydation du dioxyde PuO2 pour former un oxyde supérieur PuO2+x sur la couche de dioxyde qui semble favoriser la corrosion du métal dans l'air humide[41].
Les poudres de plutonium, de ses hydrures et de certains oxydes tels que Pu2O3 sont pyrophoriques, c'est-à-dire qu'elles peuvent prendre feu spontanément au contact de l'air à température ambiante, et sont par conséquent manipulées sous atmosphère sèche inerte d'azote N2 ou d'argon Ar. Le plutonium massif ne s'enflamme qu'au-dessus de 400 °C. Le Pu2O3 s'échauffe spontanément et se transforme en dioxyde de plutonium PuO2, qui est stable dans l'air sec, mais réagit à chaud avec la vapeur d'eau[42]. Les réactions en jeu seraient ainsi :
- 3 PuO2 + Pu ⟶ 2 Pu2O3
- 2 Pu2O3 + O2 ⟶ 4 PuO2.
Le plutonium réagit également avec l'hydrogène H2 pour former des hydrures PuHx, avec 1,9 < x < 3 :
- 2 Pu + x H2 ⟶ 2 PuHx.
La valeur de x dépend de la pression partielle d'hydrogène et de la température de réaction. Ces hydrures, qui sont solides cristallisés dans le système cubique à faces centrées, sont rapidement oxydés par l'air, et se dissocient en leurs éléments constituants lorsqu'ils sont chauffés sous vide dynamique, c'est-à-dire avec pompage continu de l'hydrogène libéré.
Sûreté
Différents types de risques sont à considérer s'agissant de la manipulation du plutonium, qui dépendent étroitement des isotopes en jeu. Les accidents de criticité surviennent lors d'erreurs de manipulation conduisant à la formation d'une masse critique de plutonium et sont susceptibles de provoquer un syndrome d'irradiation aiguë. La radiotoxicité et la reprotoxicité se manifestent à la suite de l'absorption de plutonium dans l'organisme conduisant à l'irradiation des tissus avec des rayonnements ionisants pouvant provoquer des mutations génétiques et induire des cancers.
Les isotopes du plutonium les plus courants sont avant tout des émetteurs α, irradiant des particules α de 4,9 à 5,5 MeV qui sont facilement arrêtées par toute substance solide, notamment l'épiderme. Le plutonium 241 émet des rayons β, plus pénétrants que les rayons α, mais d'à peine 5,2 keV.
D'un point de vue chimique, le plutonium est combustible et pyrophorique, de sorte qu'il présente un risque d'incendie. Sa toxicité chimique, en revanche, n'est pas particulièrement significative.
Criticité
L'accumulation de plutonium dans un volume approchant de la masse critique est susceptible de conduire au déclenchement d'une réaction nucléaire émettant une quantité létale de neutrons et de rayons γ[10]. Le risque est d'autant plus grand avec le plutonium que la masse critique du plutonium 239 n'est généralement que le tiers de celle de l'uranium 235[15]. Ce risque est accru en solution en raison de l'effet modérateur de l'hydrogène de l'eau, qui thermalise les neutrons[35].
Plusieurs accidents de criticité impliquant du plutonium ont été rapportés au XXe siècle, certains ayant entraîné la mort de personnes touchées. Ce fut par exemple le cas au laboratoire national de Los Alamos le 21 août 1945 lors d'une erreur de manipulation de briques en carbure de tungstène utilisées comme réflecteurs de neutrons autour d'une sphère en plutonium de qualité militaire, ce qui causa 25 jours plus tard la mort d'Harry Daghlian Jr., alors chercheur du projet Manhattan, à la suite d'un syndrome d'irradiation aiguë consécutif à la dose qu'il a reçue, estimée à 5,1 Sv[43],[44]. Neuf mois plus tard, Louis Slotin mourut également à Los Alamos d'un accident semblable en manipulant des réflecteurs en béryllium autour de la même sphère en plutonium, appelée demon core[45]. Toujours à Los Alamos, un accident différent est survenu en , coûtant la vie à un laborantin, nommé Cecil Kelley, lors d'une opération de purification du plutonium, à la suite de la formation d'une masse critique dans un récipient de mélange. D'autres accidents de ce type se sont produits à travers le monde, que ce soit aux États-Unis, en Union soviétique, au Japon ou dans d'autres pays[46].
Radiotoxicité
Élément synthétique produit spécifiquement pour sa radioactivité, le plutonium est surtout connu pour sa radiotoxicité. Celle-ci résulte de trois types de rayonnements ionisants : les rayons α (particules α), les rayons β (électrons) et les rayons γ (photons énergétiques). L'exposition aiguë ou prolongée à ces rayonnements présente des risques pour la santé, susceptibles de se manifester dans le cadre d'un syndrome d'irradiation aiguë, avec mutations génétiques et cancers. Les risques croissent avec la dose absorbée, mesurée en grays (Gy), et plus précisément en fonction de la dose équivalente, mesurée en sieverts (Sv), qui pondère l'impact physiologique des différents types de rayonnements reçus en fonction de leur capacité à causer des dommages dans les tissus irradiés. Cette pondération est introduite par le facteur de dose, mesuré typiquement en microsieverts par becquerel (µSv/Bq) :
-
Ainsi, les rayons γ traversent tous les tissus et touchent l'ensemble de l'organisme, tandis que les rayons β sont moins pénétrants et que les rayons α ne franchissent pas l'épiderme mais sont bien plus énergétiques (quelques mégaélectron-volts, contre quelques kiloélectron-volts pour les rayons β et γ). Ainsi, les particules α sont dangereuses lorsqu'elles sont émises au sein même des tissus par le plutonium absorbé[40]. Le principal risque est l'inhalation de particules contenant du plutonium, notamment sous forme de dioxyde de plutonium PuO2, qui se forme rapidement au contact de l'air et qui tend à se désagréger en fines poussières en présence d'humidité. On a ainsi montré une incidence accrue de fibrose pulmonaire[49],[50] et de cancer du poumon chez des salariés du secteur nucléaire[51]. Le risque de cancer du poumon croît lorsque la dose équivalente de plutonium inhalé atteint 400 mSv[52]. En revanche, l'ingestion ne permet d'absorber que 0,04 % du PuO2 ingéré[40]. Les risques concernent également les os, où le plutonium s'accumule, ainsi que le foie, où il est concentré[10].
Tous les isotopes du plutonium ne présentent pas le même niveau de radiotoxicité. Le plutonium de qualité militaire, constitué à plus de 92 % de plutonium 239, présente ainsi une radiotoxicité plutôt modérée[53], en raison de son activité massique plus faible que celle du plutonium 240 et surtout du plutonium 238. Le plutonium 241 a une activité un millier de fois plus élevée, émettant des rayons β qui sont plus pénétrants que le rayonnement α, bien qu'un millier de fois moins énergétiques.
-
Énergie par mode de désintégration[47]
| Isotope | Plutonium 238 | Plutonium 239 | Plutonium 240 | Plutonium 241 | Plutonium 242 |
|---|
| Rayonnement α |
5,5 MeV |
5,1 MeV |
5,2 MeV |
< 1 keV |
4,9 MeV |
|---|
| Rayonnement β |
11 keV |
6,7 keV |
11 keV |
5,2 keV |
8,7 keV |
|---|
| Rayonnement γ |
1,8 keV |
< 1 keV |
1,7 keV |
< 1 keV |
1,4 keV |
|---|
Le plutonium 238 présente la plus forte radiotoxicité, tandis que le plutonium 241, dont la concentration dans le plutonium croît avec le temps, produit rapidement de l'américium 241, qui émet des rayons γ énergétiques susceptibles d'exposer l'environnement à une irradiation significative[54].
La dose mortelle par syndrome d'irradiation aiguë constatée sur les expérimentations in vivo est de l'ordre de 400 à 4 000 µg/kg en une seule prise, une contamination chronique ayant des effets plus diffus[55]. On estime de ce fait qu'une quantité de l'ordre d'une dizaine de milligrammes provoque le décès d'une personne ayant inhalé en une seule fois des oxydes de plutonium. En effet, les tests effectués sur des babouins et des chiens conduisent à estimer pour l'homme une mortalité de 50 % au bout de 30 jours avec 9 mg, au bout d'un an avec 0,9 mg et 1 000 jours avec 0,4 mg[56].
L'apparition de fibroses et de tumeurs pulmonaires a été mise en évidence chez le chien et le rat après inhalation de composés peu solubles tels que les oxydes de plutonium : la relation dose-effet mise en évidence comporte un seuil d'apparition des tumeurs pour une dose au poumon autour de 1 Gy[56],[57]. Ce seuil d'apparition des tumeurs correspondrait chez l'homme à un dépôt pulmonaire d'environ 200 kBq, soit 87 µg) de 239PuO2[56].
Inflammabilité
Le plutonium présente un risque d'incendie, particulièrement lorsqu'il est sous forme de poudre finement divisée. En présence d'humidité, il forme à sa surface des hydrures qui sont pyrophoriques et sont susceptibles de prendre feu à température ambiante. Le risque est réel, et s'est matérialisé en 1969 par un important feu de plutonium au laboratoire national de Rocky Flats[58]. L'accroissement de volume résultant de l'oxydation du plutonium peut atteindre 70 % et briser les récipients de confinement[42]. La radioactivité de ce métal combustible constitue un risque supplémentaire.
L'oxyde de magnésium MgO est sans doute la substance la plus efficace pour éteindre un feu de plutonium : il refroidit le métal en agissant comme dissipateur thermique tout en coupant l'alimentation en oxygène de la combustion. Afin de prévenir les risques d'incendie, il est recommandé de manipuler le plutonium sous atmosphère sèche inerte[42].
Toxicologie
Le plutonium présente la toxicité d'un métal lourd au même titre que l'uranium, par exemple, mais elle est moins documentée que celle de ce dernier, et les études ne placent pas la toxicité chimique comme risque majeur associé au plutonium[59],[60]. Plusieurs populations exposées à des poussières de plutonium ont été suivies de près afin d'évaluer l'impact sur leur santé de leur contamination au plutonium[61], comme les personnes résidant à proximité de sites d'expérimentation nucléaires atmosphériques lorsqu'ils étaient autorisés, les personnes travaillant dans des installations nucléaires, les rescapés du bombardement atomique de Nagasaki, voire des patients « en phase terminale » de maladies mortelles à qui a été injecté du plutonium dans les années 1945-1946 pour en observer la métabolisation dans le corps humain. Ces études ne montrent généralement pas de toxicité particulièrement élevée pour le plutonium, avec des exemples de cas célèbres comme celui d'Albert Stevens, cité par Bernard Cohen (en)[60], qui vécut jusqu'à un âge avancé après avoir subi des injections de plutonium. Plusieurs dizaines de chercheurs du laboratoire national de Los Alamos ont également inhalé des quantités significatives de poussières de plutonium dans les années 1940 sans développer de cancer du poumon[62].
Certains discours antinucléaires[63],[64],[65],[66],[67],[68] affirment que « l'ingestion d'un seul millionième de gramme est fatale », ce qui n'est pas étayé par la documentation existante[69]. Les données épidémiologiques des membres du « club des UPPU[d] », c'est-à-dire des 26 personnes ayant travaillé au laboratoire national de Los Alamos sur du plutonium et en ayant ingéré au point qu'il était suivi dans les urines, montrent par exemple une mortalité et un taux de cancers inférieurs à la moyenne[70].
L'affirmation selon laquelle « Il suffirait de quelques centaines de grammes de plutonium répandue uniformément sur terre, pour y effacer toute forme de vie humaine »[68] n'est pas non plus conforme aux données disponibles. On estime en effet que la dispersion d'une masse de l'ordre du kilogramme sur une surface de quelques centaines de kilomètres carrés (soit dans un rayon d'environ 10 km) conduit à une contamination inférieure au centième de microgramme par mètre carré[67],[71], de sorte quelques centaines de grammes répartis uniformément à la surface de la Terre seraient bien en deçà de toute quantité détectable.
Il convient également de distinguer la radiotoxicité du plutonium 238, qui est particulièrement élevée, de celle du plutonium 239 employé par l'armée et l'industrie nucléaire, dont la radioactivité spontanée est sensiblement moindre. Ces deux isotopes sont produits en quantités très différentes, par des circuits distincts et pour des usages qui n'ont aucun rapport : le plutonium 238 est produit à raison de quelques kilogrammes essentiellement comme source d'énergie embarquée pour générateur thermoélectrique à radioisotope, tandis que le plutonium 239 est produit à raison de plusieurs tonnes pour tirer profit de sa nature d'isotope fissile dans des réacteurs nucléaires ou des armes nucléaires[72].
Toxicodynamique
Chez l'homme, le plutonium absorbé est transporté par des transferrines[73],[74],[75],[76] et est stocké dans le sang par la ferritine[77],[78],[79],[80] pour finir par s'accumuler essentiellement dans les os, également dans le foie, et, dans une moindre mesure, dans les poumons[81]. Il demeure dans le corps humain avec une demi-vie biologique d'environ 50 ans[82]. Un moyen courant d'en limiter les effets est d'injecter un complexe d'acide diéthylène-triamine penta-acétique[83],[84],[85] (DTPA, parfois appelé « acide pentétique ») avec du calcium[86] ou du zinc[87] dans les 24 h suivant la contamination, ce qui limite la fixation du plutonium, ainsi que de l'américium et du curium. D'autres chélateurs peuvent également être utilisés, comme l'entérobactine[88] et la déféroxamine, certains avec une meilleure efficacité que le DTPA, comme le 3,4,3-LIHOPO ou la DFO-HOPO[89] (déféroxamine-hydroxypyridinone).
On estime que chez l'Homme, 10 % du plutonium qui a franchi la barrière intestinale ou pulmonaire quitte le corps (via l'urine, et les excréments). Le reste après passage dans le sang se fixe pour moitié dans le foie et pour moitié dans le squelette, où il demeure très longtemps et pour partie à vie (Le DOE américain estime que la demi-vie dans l'organe est respectivement de 20 et 50 ans pour le foie et l'os, selon des modèles simplifiés ne tenant pas compte de redistributions intermédiaires (en cas de fracture et/ou de ménopause (cf. décalcification) et lors du recyclage normal de l'os, etc). Le DOE précise que le taux accumulé dans le foie et le squelette dépend aussi de l'âge de l'individu (l'absorption dans le foie augmente avec l'âge), et qu'en fait, le plutonium se fixe d'abord sur la surface corticale et trabéculaire des os avant d'être lentement redistribué dans tout le volume minéral osseux.
Applications
Militaires
Le plutonium 239 est un isotope fissile clé pour la réalisation d'armes nucléaires en raison de sa relative facilité de mise en œuvre et de sa disponibilité assez élevée. Il est possible de réduire la masse critique nécessaire à l'explosion en entourant le cœur de plutonium par des réflecteurs de neutrons qui ont le double rôle d'augmenter le flux de neutrons thermiques dans le cœur et de retarder l'expansion thermique de ce dernier afin d'y prolonger la réaction en chaîne et d'accroître la puissance de l'explosion nucléaire.
Une masse de 10 kg de plutonium 239 sans réflecteur suffit généralement pour atteindre la criticité[90] ; cette masse peut être divisée par deux par une conception optimisée. C'est environ le tiers de la masse critique de l'uranium 235.
La bombe Fat Man larguée sur Nagasaki par les États-Unis le 9 août 1945 utilisait une charge de 6,4 kg d'alliage plutonium-gallium 239Pu-240Pu-Ga 96:1:3 autour d'une source de neutrons d'amorçage Be-210Po le tout cerné de lentilles explosives comprimant le plutonium pour en accroître significativement la masse volumique et donc la puissance de l'explosion, qui atteignit l'équivalent de 20 000 t de TNT[91]. Il est en théorie possible de réduire la masse de plutonium nécessaire dans une arme nucléaire pour atteindre la criticité à moins de 4 kg moyennant une conception suffisamment élaborée.
Civiles
Le combustible nucléaire usagé provenant de réacteurs à eau légère conventionnels contient un mélange d'isotopes 238Pu, 239Pu, 240Pu et 242Pu. Ce mélange n'est pas suffisamment enrichi en plutonium 239 pour permettre la réalisation d'armes nucléaires mais peut être recyclé en combustible MOX. Les captures neutroniques accidentelles au cours de la réaction nucléaire accroissent la quantité de plutonium 240 et de plutonium 242 chaque fois que le plutonium est irradié dans un réacteur à neutrons thermiques de sorte que, à l'issue d'un premier cycle, le plutonium ne peut plus être utilisé que par des réacteurs à neutrons rapides. Si de tels réacteurs ne sont pas disponibles, ce qui est généralement le cas, le plutonium en excès est généralement éliminé en formant des déchets radioactifs à vie longue. La volonté de réduire la quantité de tels déchets et de les valoriser a poussé à réaliser davantage de réacteurs à neutrons rapides[92].
Le procédé chimique le plus courant, dit PUREX, permet le retraitement du combustible nucléaire usé en extrayant le plutonium et l'uranium qu'il contient afin de former un mélange d'oxydes dit MOX, essentiellement du dioxyde d'uranium UO2 et du dioxyde de plutonium PuO2, pouvant être utilisé à nouveau dans des réacteurs nucléaires. Du plutonium de qualité militaire peut être ajouté à ce mélange pour en accroître les performances énergétiques. Le MOX peut être utilisé dans les réacteurs à eau légère et contient environ 60 kg par tonne de combustible ; après quatre années d'utilisation, les trois quarts du plutonium sont consommés. Les surgénérateurs sont conçus afin d'optimiser l'utilisation des neutrons produits au cours de la réaction nucléaire en les utilisant pour produire, à partir d'atomes fertiles, davantage de matériau fissile qu'ils en consomment[92].
Le MOX est utilisé depuis les années 1980, notamment en Europe. Les États-Unis et la Russie ont signé, en , l'Accord de gestion et de traitement du plutonium (PMDA) par lequel ils entendent éliminer 34 tonnes de plutonium de qualité militaire ; le DOE américain prévoit d'avoir recyclé cette masse de plutonium en MOX avant la fin de l'année 2019[93].
Le MOX accroît le rendement énergétique total. Une barre de combustible nucléaire est retraitée après une utilisation de trois ans afin d'en extraire les déchets, qui représentent alors environ 3 % de la masse totale de ces barres[40]. Les isotopes d'uranium et de plutonium produits au cours de ces trois années d'exploitation[e] sont laissés dans la barre de combustible, qui retourne dans un réacteur pour y être utilisé. La présence de gallium jusqu'à hauteur de 1 % pondéral dans le plutonium de qualité militaire peut interférer avec l'utilisation à long terme de ce matériau dans un réacteur à eau légère[94].
Les plus grandes installations déclarées de recyclage du plutonium sont les unités B205 (en) et THORP (en)[f] de Sellafield, au Royaume-Uni ; l'usine de retraitement de la Hague, en France ; l'usine nucléaire de Rokkasho, au Japon ; et le complexe nucléaire Maïak en Russie ; il existe d'autres sites déclarés plus modestes, par exemple en Inde et au Pakistan.
Spatiales
Le plutonium 238 a une demi-vie de 87,74 ans. Il émet une grande quantité d'énergie thermique accompagnée de faibles flux de neutrons et de photons d'énergie gamma. Un kilogramme de cet isotope peut dégager une puissance thermique d'environ 570 W. Il émet principalement des particules α d'énergie élevée mais qui sont faiblement pénétrantes, de sorte qu'il ne nécessite qu'un blindage léger. Une feuille de papier suffit pour arrêter des rayons α[96].
Ces caractéristiques font de cet isotope du plutonium une source thermique particulièrement intéressante pour les applications embarquées devant fonctionner sans possibilité de maintenance directe pendant la durée d'une vie humaine. Il a par conséquent été utilisé comme source de chaleur dans les générateurs thermiques à radioisotope (RTG) et éléments chauffants à radioisotope (RHU) comme ceux des sondes Cassini-Huygens[97], Voyager, Galileo et New Horizons, ainsi que le rover Curiosity de Mars Science Laboratory.
Les sondes jumelles Voyager ont été lancées en 1977, chacune avec une source en plutonium libérant une puissance de 500 W. Plus de 30 ans plus tard, ces sources d'énergie libéraient encore une puissance de 300 W permettant un fonctionnement limité des sondes[98]. Une version plus ancienne de cette technologie alimentait les cinq Apollo Lunar Surface Experiments Packages à partir d'Apollo 12 en 1969[40].
Le plutonium 238 a également été utilisé avec succès pour alimenter des stimulateurs cardiaques afin d'éviter les interventions chirurgicales répétées pour remplacer la source d'énergie[99]. Le plutonium 238 a depuis été largement remplacé dans cet usage par les piles au lithium, mais il restait encore en 2003 entre 50 et 100 patients aux États-Unis équipés de stimulateurs cardiaques alimentés au plutonium 238[100].
Sécurité
Le plutonium étant susceptible d'être utilisé à des fins militaires ou terroristes, il fait l'objet de nombreux textes et conventions internationaux visant à en prévenir la prolifération. Le plutonium recyclé à partir de combustible nucléaire usé présente un risque de prolifération limité en raison de sa contamination élevée en isotopes non fissiles tels que le plutonium 240 et le plutonium 242, dont l'élimination n'est pas réalisable.
Un réacteur opérant avec un taux de combustion très faible produit peu de ces isotopes indésirables et laisse donc un matériau nucléaire potentiellement utilisable à des fins militaires. Le plutonium de qualité militaire est censé être constitué au moins de 92 % de plutonium 239, mais il est techniquement possible de faire exploser une bombe nucléaire de faible puissance à partir de plutonium ne contenant que 85 % de plutonium 239[g]. Le plutonium produit par un réacteur à eau légère avec un taux de combustion normal contient généralement moins de 60 % de plutonium 239, 10 % de plutonium 241 fissile et jusqu'à 30 % d'isotopes indésirables plutonium 240 et 242. On ignore s'il est possible de faire exploser un engin nucléaire constitué d'un tel matériau, cependant un tel engin pourrait probablement répandre de la matière radioactive sur une surface étendue.
L'Agence internationale de l'énergie atomique classifie ainsi tous les isotopes du plutonium, qu'ils soient fissiles ou non, comme matériau directement utilisable à des fins nucléaires, c'est-à-dire comme matériau nucléaire qui peut être utilisé pour la fabrication d'explosifs nucléaires sans transmutation ni enrichissement supplémentaire. En France, le plutonium est une matière nucléaire dont la détention est réglementée par le chapitre III du code de la Défense[102].
Origine
Le plutonium est un élément chimique qui est des plus rares dans la nature et presque exclusivement produit par l'homme de 1940 à nos jours. Cependant, de 4 à 30 kg de plutonium 239 seraient produits chaque année sur Terre par radioactivité α de l'uranium sur des éléments plus légers ainsi que sous l'effet des rayons cosmiques[103]. C'est le deuxième des transuraniens à avoir été découvert.
L'isotope 238Pu a été produit en 1940 en bombardant une cible d'uranium par du deutérium au cyclotron de Berkeley[104]. Durant le projet Manhattan, le plutonium 239 avait le nom de code 49, le '4' étant le dernier chiffre de 94 (le numéro atomique) et le '9', le dernier chiffre de 239, la masse atomique de l'isotope utilisé pour la bombe, le 239Pu[105].
Il n'y a plus de plutonium en quantités détectables remontant à une nucléosynthèse primordiale. Des publications anciennes font toutefois état d'observations de plutonium 244 naturel[106]. On trouve par ailleurs des traces de plutonium 239 dans les minerais d'uranium naturel (de même que du neptunium), où il résulte de l'irradiation de l'uranium par le très faible taux de neutrons créés par la désintégration spontanée de l'uranium.
Il a été produit plus massivement (et existe encore en quantités infimes) sous forme de 239Pu dans des structures géologiques particulières, où de l'uranium a été naturellement concentré par des processus géologiques il y a environ 2 milliards d'années, pour atteindre une criticité suffisante pour engendrer une réaction nucléaire naturelle. Son taux de formation dans le minerai d'uranium a ainsi été accéléré par des réactions nucléaires rendues possibles par un accident de criticité naturel. C'est le cas sur le site du réacteur nucléaire naturel d'Oklo.
Production
Plutonium 238
 Chargement d'un générateur thermoélectrique à radioisotope au plutonium 238 sur le module lunaire Apollo.
Chargement d'un générateur thermoélectrique à radioisotope au plutonium 238 sur le module lunaire Apollo.
Dans les centrales nucléaires, du plutonium 238 est formé parallèlement au plutonium 239, par la chaîne de transformation commençant par l'uranium 235 fissible.
- L'uranium 235 qui capture un neutron thermique peut se stabiliser par émission d'un rayonnement γ dans 16 % des cas. Il forme alors un atome 236U, relativement stable (demi-vie de 23 millions d'années).
- Une deuxième capture neutronique le transforme en 237U (pour mémoire, des noyaux 238U peuvent également subir une réaction (n, 2n) qui les transforme en 237U par perte d'un neutron). L'uranium 237 est instable avec une demi-vie de 6,75 jours, et se transforme par émission β− en neptunium 237, relativement stable (demi-vie de 2,2 millions d'années).
- Une troisième capture neutronique transforme le noyau en neptunium 238, instable de demi-vie 2,1 jours, qui se transforme en plutonium 238 par émission β−.
Le plutonium 238, d'une demi-vie de 86,41 ans, est un émetteur très puissant de rayonnement α. En raison de son activité massique α et γ élevée, il est utilisé comme source de neutrons (par « réaction α » avec des éléments légers), comme source de chaleur et comme source d'énergie électrique (générateurs thermoélectriques à radiositopes). Les utilisations du 238Pu pour produire de l'électricité sont cantonnées aux utilisations spatiales, et, par le passé, à certains stimulateurs cardiaques.
On prépare le plutonium 238 à partir de l'irradiation neutronique du neptunium 237, un actinide mineur récupéré pendant le retraitement, ou à partir de l'irradiation de l'américium, en réacteur. Dans les deux cas, pour extraire le plutonium 238 des cibles, on les soumet à un traitement chimique, comportant une dissolution nitrique.
Il n'y a qu'environ 700 g/t de neptunium 237 dans le combustible des réacteurs à eau ordinaire irradié pendant 3 ans, et il faut l'extraire sélectivement.
Plutonium 239
L'irradiation de l'uranium 238 dans les réacteurs nucléaires génère du plutonium 239 par capture de neutrons. Dans un premier temps, un atome d'uranium 238 capture un neutron et se transforme transitoirement en uranium 239. Cette réaction de capture est plus facile avec des neutrons rapides qu'avec des neutrons thermiques, mais est présente dans les deux cas.
- 1
0n + 238
92U ⟶ 239
92U.
L'uranium 239 formé est fortement instable. Il se transforme rapidement (avec une demi-vie de 23,5 minutes) en neptunium par radioactivité β− :
- 239
92U ⟶ 239
93Np + e− + νe.
Le neptunium 239 est également instable, et subit à son tour une décroissance β− (avec une demi-vie de 2,36 jours) qui le transforme en plutonium 239 relativement stable (demi-vie de 24 000 ans).
- 239
93Np ⟶ 239
94Pu + e− + νe.
Le plutonium 239 est fissile, et il peut donc contribuer à la réaction en chaine du réacteur. De ce fait, pour le bilan énergétique d'un réacteur nucléaire, le potentiel énergétique de l'uranium présent dans le réacteur comprend non seulement celui de l'uranium 235 initialement présent, mais également celui de l'uranium 238 fertile qui aura été transmuté en plutonium.
Soumis à un flux neutronique en réacteur, le plutonium 239 peut également capturer un neutron sans subir de fission. Quand le combustible subit des périodes d'irradiation de plus en plus longues, les isotopes supérieurs s'accumulent de cette manière, en raison de l'absorption de neutrons par le plutonium 239 et ses produits. Il se forme ainsi des isotopes 240Pu, 241Pu, 242Pu, jusqu'au 243Pu instable qui se désintègre en américium 243.
L'isotope intéressant par son caractère fissile est le 239Pu, relativement stable à échelle humaine (24 000 ans).
Le rythme de production d'un isotope dépend de la disponibilité de son précurseur, qui doit avoir eu le temps de s'accumuler. Dans un combustible neuf, le 239Pu se forme donc linéairement en fonction du temps, la proportion de 240Pu augmente suivant une loi au carré du temps (en t2), celle de 241Pu suivant une loi au cube du temps (en t3), et ainsi de suite.
Ainsi, quand on utilise un réacteur spécifique pour la fabrication du « plutonium militaire », le combustible utilisé pour la production du plutonium aussi bien que les cibles et la couverture s'il y en a, sont extraits après un bref séjour (quelques semaines) dans le réacteur afin d'avoir l'assurance que le plutonium 239 est aussi pur que possible. En revanche, pour des usages civils, une brève irradiation n'extrait pas toute l'énergie que le combustible peut produire. On n'enlève donc le combustible des réacteurs électrogènes qu'après un séjour beaucoup plus long (3 ou 4 ans).
En première approximation, un réacteur produit typiquement 0,8 atome de 239Pu pour chaque fission de 235U, soit un gramme de plutonium par jour et par MW de puissance thermique (les réacteurs à eau légère produisant moins que les graphite-gaz). Ainsi, en France, les réacteurs nucléaires produisent chaque année environ 11 tonnes de plutonium[107].
Plutonium 240
Le 240Pu est simplement fertile et présente une radioactivité « seulement » quatre fois plus élevée que le 239Pu (avec une demi-vie de 6 500 ans).
Plutonium 241
Le 241Pu est également fissile, mais extrêmement radioactif (demi-vie de 14,29 ans).
En outre il se désintègre en produisant de l'américium 241 neutrophage, qui réduit par son accumulation éventuelle l'efficacité des dispositifs nucléaires militaires ou civils.
Plutonium 242
Le 242Pu a une durée de vie beaucoup plus longue que les précédents (373 000 ans). Il n'est pas fissile en neutrons thermiques. Sa section efficace est beaucoup plus faible que celle des autres isotopes ; le recyclage successif du plutonium en réacteur tend donc à accumuler le plutonium sous cette forme très peu fertile.
Plutonium 243
Le 243Pu est instable (demi-vie de moins de 5 heures) et se désintègre en américium 243.
Plutonium 244
Le plutonium 244, l'isotope le plus stable d'une demi-vie de 80 millions d'années, ne se forme pas dans les réacteurs nucléaires. En effet, les captures neutroniques successives partant de l'uranium 239 conduisent au 243Pu, de très faible demi-vie (de l'ordre de cinq heures). Même dans des réacteurs « à haut flux », le 243Pu se transforme rapidement en 243Am, sans avoir le temps de capturer un neutron supplémentaire pour former le 244Pu.
En revanche, des flux neutroniques plus importants permettent cette formation. Il est synthétisé lors des explosions nucléaires ou par nucléosynthèse stellaire lors de l'explosion d'une supernova. Ainsi, en 1952, l'explosion de la première bombe thermonucléaire américaine (test Ivy Mike) a ainsi produit deux radioisotopes alors encore inconnus : le plutonium 244 (244Pu) et le plutonium 246 (246Pu). Les traces de 244Pu dans l'environnement sont généralement attribuées aux essais nucléaires atmosphériques ainsi qu'à des reliquats de 244Pu primordial.
Stocks mondiaux
Après près de 70 ans d'une production mondiale toujours croissante, les stocks déclarés de plutonium atteignent un total de 500 tonnes à la fin de l'année 2013, dont 52 % d'origine civile et 48 % militaire[108]. Les stocks déclarés sont essentiellement répartis entre 5 pays :
- Russie : 178 tonnes soit 35,6 %
- Royaume-Uni : 107,2 tonnes soit 21,4 %
- États-Unis : 88,3 tonnes soit 17,7 %
- France : 66,2 tonnes soit 13,2 %
- Japon : 47,1 tonnes soit 9,4 %
- Reste du monde : 13 tonnes soit 3 %
Notes
- À la température de transition de phase.
- Masse volumique correspondante donnée à 0 °C.
- L'ion PuO2+ est instable en solution et se dismute en Pu4+ et PuO22+ ; le Pu4+ oxyde alors le PuO2+ résiduel en PuO22+ en devenant lui-même du Pu3+. Une solution de PuO2+ devient donc au fil du temps un mélange de PuO22+ et de Pu3+. L'ion UO2+ est instable pour la même raison[36].
- En anglais, UPPU se lit you pee Pu, c'est-à-dire « tu pisses du plutonium ».
- La composition isotopique du plutonium dans un combustible nucléaire usagé est de l'ordre de 58 % de 239Pu, 24 % de 240Pu, 11 % de 241Pu, 5 % de 242Pu et 2 % de 238Pu[40].
- Une fuite importante de plutonium et d'uranium est survenue le 19 avril 2005 à l'usine THORP (en) à la suite d'une rupture de soudure dans une des cuves de retraitement. 200 kg de plutonium ont été perdus avec 83 000 L de matière radioactive provenant d'une cuve en béton armé conçue pour recueillir d'éventuelles pertes. Cette fuite a fait suite à une rupture de canalisation qui n'avait pas été détectée, les techniciens ayant ignoré, durant plusieurs mois, les indicateurs d'alerte à ce sujet, qui signalaient une perte de masse dans la cuve signifiant une fuite. Craignant un accident de criticité, l'autorité de sûreté a provisoirement fermé l'une des deux installations jumelles[95].
Notes et références
- (en) Beatriz Cordero, Verónica Gómez, Ana E. Platero-Prats, Marc Revés, Jorge Echeverría, Eduard Cremades, Flavia Barragán et Santiago Alvarez, « Covalent radii revisited », Dalton Transactions, , p. 2832 - 2838 (DOI 10.1039/b801115j)
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, CRC, , 89e éd., p. 10-203
- (en) John W. Arblaster, Selected Values of the Crystallographic Properties of Elements, ASM International, 2018 (ISBN 978-1-62708-155-9).
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, CRC Press Inc, , 90e éd., 2804 p., Relié (ISBN 978-1-420-09084-0)
- (en) David L. Clark, Gordon Jarvinen, Cynthia Kowalczyk, Jim Rubin et Mary Ann Stroud, « Nitric Acid Processing [archive] » [PDF], Actinide Research Quarterly — 3rd Quarter 2008, sur Actinide Research Quarterly (ARQ) sur le site du Los Alamos National Laboratory, Seaborg Institute for Transactinium Science, (consulté le ), p. 10.
- (en) David L. Clark, Gordon Jarvinen, Cynthia Kowalczyk, Jim Rubin et Mary Ann Stroud, « Nitric Acid Processing [archive] » [PDF], Actinide Research Quarterly — 3rd Quarter 2008, sur Actinide Research Quarterly (ARQ) sur le site du Los Alamos National Laboratory, Seaborg Institute for Transactinium Science, (consulté le ), p. 6 :
« While plutonium dioxide is normally olive green, samples can be various colors. It is generally believed that the color is a function of chemical purity, stoichiometry, particle size, and method of preparation, although the color resulting from a given preparation method is not always reproducible. »
.
- (en) A. Michael Boring et James L. Smith, « Plutonium Condensed-Matter Physics – A survey of theory and experiment », Los Alamos Science, no 26, , p. 90-127 (lire en ligne [archive])
- (en) Siegfried S. Hecker, « Plutonium and Its Alloys – From atoms to microstructure », Los Alamos Science, no 26, , p. 290-335 (lire en ligne [archive])
- (en) Siegfried S. Hecker et Michael F. Stevens, « Mechanical Behavior of Plutonium and Its Alloys », Los Alamos Science, no 26, , p. 336-355 (lire en ligne [archive])
- (en) William N. Miner et Fred W. Schonfeld, « Plutonium », The Encyclopedia of the Chemical Elements, 1968, Clifford A. Hampel, Reinhold Book Corporation, New York, pp. 540–546
- (en) Siegfried S. Hecker, « Plutonium, an element at odds with itself », Los Alamos Science, no 26, , p. 16-23 (lire en ligne [archive])
- (en) Siegfried S. Hecker et Joseph C. Martz, « Aging of Plutonium and Its Alloys », Los Alamos Science, no 26, , p. 238-243 (lire en ligne [archive])
- (en) Dana C. Christensen, « The Future Role of Plutonium Technology », Los Alamos Science, no 23, , p. 168-173 (lire en ligne [archive])
- (en) « Chart of Nuclides »(Archive.org • Wikiwix • Archive.is • http://www.nndc.bnl.gov/chart/reCenter.jsp?z=94&n=150" rel="nofollow" class="external text">Google • Que faire ?), sur National Nuclear Data Center (consulté le ).
- (en) David L. Heiserman, « Element 94: Plutonium », Exploring Chemical Elements and their Compounds, 1992, TAB Books, New York (NY), pp. 337–340. (ISBN 0-8306-3018-X).
- (en) Isaac Asimov, Nuclear Reactors, Understanding Physics, 1988, Barnes & Noble Publishing, New York. (ISBN 0-88029-251-2).
- (en) Samuel Glasstone et Leslie M. Redman, « An introduction to nuclear weapons » [PDF], sur web.archive.org, Atomic Energy Commission, (consulté le ).
- (en) F. G. Gosling, (1999). The Manhattan Project: Making the Atomic Bomb [archive] « Copie archivée » (version du sur Internet Archive) [PDF], 1999, United States Department of Energy, Oak Ridge. (ISBN 0-7881-7880-6)
- (en) « Plutonium: the 50 Years » [PDF], sur web.archive.org, U.S. Department of Energy, (consulté le ).
- (en) J. W. Kennedy, G. T. Seaborg, E. Segrè et A. C. Wahl, « Properties of 94(239) », Physical Review, vol. 70, nos 7-8, , p. 555-556 (DOI 10.1103/PhysRev.70.555, Bibcode 1946PhRv...70..555K, lire en ligne [archive])
- (en) Louis A. Turner, « Atomic Energy from U238 », Physical Review, vol. 69, nos 7-8, , p. 366-366 (DOI 10.1103/PhysRev.69.366, Bibcode 1946PhRv...69..366T, lire en ligne [archive])
- (en) David L. Heiserman, Exploring Chemical Elements and their Compounds, New York (NY), TAB Books, , 1re éd., 376 p. (ISBN 978-0-8306-3018-9, LCCN 91017687), « Element 94: Plutonium », p. 337–340
- (en) Richard Rhodes, The Making of the Atomic Bomb, New York, Simon & Schuster, , 1re éd., 886 p., poche (ISBN 978-0-671-65719-2, LCCN 86015445), p. 659–660 Leona Marshall : « Quand vous en prenez un lingot en main, on sent qu'il est chaud comme un lapin vivant ».
- K. Beaugelin-Seiller, D. Boust, P. Germain, S. Roussel-Debet et C. Colle, « Plutonium et environnement [archive] » [PDF], Fiche Radionucléide, sur irsn.fr, Institut de radioprotection et de sûreté nucléaire, (consulté le ).
- (en) « Can Reactor Grade Plutonium Produce Nuclear Fission Weapons? [archive] », sur cnfc.or.jp, Council for Nuclear Fuel Cycle Institute for Energy Economics Japan, (consulté le ).
- (en) « Plutonium, Radioactive [archive] » [html], National Institutes of Health (consulté le ).
- (en) « Plutonium Crystal Phase Transitions [archive] », GlobalSecurity.org.
- (en) Kenton James Moody, Ian D. Hutcheon et Patrick M. Grant, Nuclear forensic analysis, 2005, CRC Press, p. 169. (ISBN 0-8493-1513-1)
- (en) David G. Kolman et Lisa P. Colletti, « Aqueous Corrosion Behavior of Plutonium Metal and Plutonium–Gallium Alloys Exposed to Aqueous Nitrate and Chloride Solutions », Journal of the Electrochemical Society, vol. 155, no 12, , C565-C570 (DOI 10.1149/1.2976352, lire en ligne [archive])
- (en) D. G. Hurst, A. G. Ward, Canadian Research Reactors [archive] [PDF], 1956, Atomic Energy of Canada Limited, Ottawa.
- (en) A. E. Kay, Plutonium 1965, 1965, Taylor & Francis.
- (en) Gerard L. Hofman, R. G. Pahl, C. E. Lahm et D. L. Porter, « Swelling behavior of U-Pu-Zr fuel », Metallurgical Transactions A, vol. 21, no 2, , p. 517-528 (DOI 10.1007/BF02671924, Bibcode 1990MTA....21..517H, lire en ligne [archive])
- (en) R. G. Pahl, D. L. Porter, C. E. Lahm et G. L. Hofman, « Experimental studies of U-Pu-Zr fast reactor fuel pins in the experimental breeder reactor-ll », Metallurgical Transactions A, vol. 21, no 7, , p. 1863–1870 (DOI 10.1007/BF02647233, Bibcode 1990MTA....21.1863P, lire en ligne [archive])
- (en) David L. Clark, « The Chemical Complexities of Plutonium », Los Alamos Science, no 26, , p. 364-381 (lire en ligne [archive])
- (en) David R. Lide, Handbook of Chemistry and Physics, 2006, CRC Press, Taylor & Francis Group 87e édition, Boca Raton. (ISBN 0-8493-0487-3)
- (en) William J. Crooks, « Nuclear Criticality Safety Engineering Training Module 10 – Criticality Safety in Material Processing Operations, Part 1 [archive] » [PDF], 2002.
- (en) Cory J. Windorff, Guo P. Chen, Justin N. Cross, William J. Evans, Filipp Furche, Andrew J. Gaunt, Michael T. Janicke, Stosh A. Kozimor et Brian L. Scott, « Identification of the Formal +2 Oxidation State of Plutonium: Synthesis and Characterization of {PuII[C5H3(SiMe3)2]3}− », Journal of the American Chemical Society, vol. 139, no 11, , p. 3970-3973 (PMID 28235179, DOI 10.1021/jacs.7b00706, lire en ligne [archive])
- (en) George Matlack, A Plutonium Primer: An Introduction to Plutonium Chemistry and Its Radioactivity [archive], Los Alamos national Laboratory, janvier 2003.
- (en) Mary Eagleson, Concise Encyclopedia Chemistry, 1994, Walter de Gruyter, Berlin, p. 840. (ISBN 978-3-11-011451-5).
- (en) John Emsley, (2001). « Plutonium », Nature's Building Blocks: An A–Z Guide to the Elements, 2001, Oxford University Press, Oxford (UK). (ISBN 0-19-850340-7).
- (en) John M. Haschke, Thomas H. Allen et Luis A. Morales, « Surface and Corrosion Chemistry of Plutonium », Los Alamos Science, no 26, , p. 252-273 (lire en ligne [archive])
- (en) « Plutonium », Primer on Spontaneous Heating and Pyrophoricity, sur web.archive.org, U.S. Department of Energy, Washington, D.C. 20585, (consulté le ).
- (en) Kevin N. Roark, « Criticality accidents report issued », laboratoire national de Los Alamos, 8 octobre 2008
- (en) Jon Hunner, Inventing Los Alamos, 2004 (ISBN 978-0-8061-3891-6).
- (en) « Raemer Schreiber », Staff Biographies, Los Alamos 16 novembre 2008.
- (en) William R. Stratton, « A Review of Criticality Accidents [archive] » [PDF], Laboratoire national de Los Alamos, (consulté le ).
- (en) John Peterson, Margaret MacDonell, Lynne Haroun et Fred Monette, « Radiological and Chemical Fact Sheets to Support Health Risk Analyses for Contaminated Areas [archive] » [PDF], sur Radiation Emergency Medical Management, Argonne National Laboratory Environmental Science Division, (consulté le ).
- Ch. O. Bacri, « La gestion des déchets nucléaires »(Archive.org • Wikiwix • Archive.is • http://institut.in2p3.fr/actions/formation/PhyAuDet10/cycle_combustible_Bacri.pdf" rel="nofollow" class="external text">Google • Que faire ?) [PDF], De la physique au détecteur, sur in2p3.fr, IN2P3, (consulté le ), p. 17.
- Lee S. Newman, Margaret M. Mroz et A. James Ruttenber, « Lung Fibrosis in Plutonium Workers », Radiation Research, vol. 164, no 2, , p. 123–131 (ISSN 0033-7587 et 1938-5404, DOI 10.1667/rr3407, lire en ligne [archive], consulté le )
- Tamara Azizova, Maria Moseeva, Evgeniya Grigoryeva et Galina Zhuntova, « Registry of Plutonium-induced Lung Fibrosis in a Russian Nuclear Worker Cohort », Health Physics, vol. 118, no 2, , p. 185–192 (ISSN 1538-5159 et 0017-9078, DOI 10.1097/hp.0000000000001131, lire en ligne [archive], consulté le )
- (en) James Grellier, Will Atkinson, Philippe Bérard, Derek Bingham, Alan Birchall, Eric Blanchardon, Richard Bull, Irina Canu Guseva, Cécile Challeton-de Vathaire, Rupert Cockerill, Minh T. Do, Hilde Engels, Jordi Figuerola, Adrian Foster, Luc Holmstock, Christian Hurtgen, Dominique Laurier, Matthew Puncher, Anthony E. Riddell, Eric Samson, Isabelle Thierry-Chef, Margot Tirmarche, Martine Vrijheid et Elisabeth Cardis, « Risk of lung cancer mortality in nuclear workers from internal exposure to alpha particle-emitting radionuclides », Epidemiology, (DOI 10.1097/EDE.0000000000000684, lire en ligne [archive])
- (en) Shannon C. Brown, Margaret F. Schonbeck, David McClure, Anna E. Barón, William C. Navidi, Tim Byers et A. James Ruttenber, « Lung Cancer and Internal Lung Doses among Plutonium Workers at the Rocky Flats Plant: A Case-Control Study », American Journal of Epidemiology, vol. 160, no 2, , p. 163-172 (PMID 15234938, DOI 10.1093/aje/kwh192, lire en ligne [archive])
- FAS fact sheet [archive]
- (en) Reuben Rainisch, « Effect of Americium-241 Content on Plutonium Radiation Source Terms [archive] » [PDF], American Nuclear Society 1999 Annual Meeting and Embedded Topical at Boston, (consulté le ).
- (en) William Moss et Roger Eckhardt, « The Human Plutonium Injection Experiments », Los Alamos Science, vol. 23, , p. 177-233 (lire en ligne [archive])
- Guillaume Phan, François Rebière, Jean-Michel Deligne et Jean-René Jourdain, « Plutonium : Aspects sanitaires [archive] » [PDF], Fiche radionucléide, sur centredoc.ecole-eme.fr de l'École des métiers de l'environnement (France), IRSN, (consulté le ), p. 5.
- Fiche radiotoxicologique Plutonium [archive], CEA, décembre 2005.
- (en) David Albright et Kevin O'Neill, « The Lessons of Nuclear Secrecy at Rocky Flats », sur web.archive.org, Institute for Science and International Security, (consulté le ).
- (en) Bernard L. Cohen, « Hazards from Plutonium Toxicity », Health Physics, vol. 32, no 5, , p. 359-379 (PMID 881333, DOI 10.1097/00004032-197705000-00003, lire en ligne [archive])
- (en) Bernard L. Cohen, « The Myth of Plutonium Toxicity », sur web.archive.org, (consulté le ).
- (en) « Toxicological Profile for Plutonium [archive] », sur ATSDR Toxic Substances Portal, Agency for Toxic Substances & Disease Registry, (consulté le ).
- (en) G. L. Voelz, « What We Have Learned about Plutonium from Human Data », Health Physics, vol. 29, no 4, , p. 551-561 (PMID 1205858, DOI 10.1097/00004032-197510000-00011, lire en ligne [archive])
- radioactivité naturelle et artificielle [archive], l'électron libre, 12/2002
- Nucléaire : comment en sortir ? [archive], Réseau "Sortir du nucléaire", 2007.
- La lettre d'information avril 2011 [archive], EELV Midi-Pyrénées.
- Fleur Australe [archive], Géraldine Danon, Flammarion -Arthaud, 2012.
- L’exploration spatiale, "nouvelle frontière" du nucléaire ? [archive], Sortir du nucléaire no 56 - Hiver 2012-2013
- Y'a quéqu' chose qui cloche là-d'dans... [archive], Le blog de Gdalia Roulin, Mediapart, 4 juillet 2015.
- (en) « Toxicological Profile for Plutonium [archive] » [PDF], Toxic Substances Portal, sur ATSDR - Plutonium, Agency for Toxic Substances and Disease Registry (ATSDR) et U.S. Environmental Protection Agency (EPA), (consulté le ).
- (en) Jeremy Bernstein, Plutonium : a history of the world's most dangerous element, 2007, Joseph Henry Press, Washington, D.C. (ISBN 978-0-309-10296-4)
- The Curiosity Mission: Nukes in Space [archive], Karl Grossman.
- Plutonium Watch: Tracking Plutonium Inventories [archive], ISIS Reports, June 2004.
- (en) G. A. Turner et D. M. Taylor, « The Binding of Plutonium to Serum Proteins in Vitro », Radiation Research, vol. 36, no 1, , p. 22-30 (PMID 17387923, DOI 10.2307/3572534, JSTOR 3572534, lire en ligne [archive])
- (en) A. R. Chipperfield et D. M. Taylor, « Binding of Plutonium to Glycoproteins in Vitro », Radiation Research, vol. 43, no 2, , p. 393-402 (PMID 5465552, DOI 10.2307/3573043, JSTOR 3573043, lire en ligne [archive])
- (en) Mark P. Jensen, Drew Gorman-Lewis, Baikuntha Aryal, Tatjana Paunesku, Stefan Vogt, Paul G. Rickert, Soenke Seifert, Barry Lai, Gayle E. Woloschak et L. Soderholm, « An iron-dependent and transferrin-mediated cellular uptake pathway for plutonium », Nature Chemical Biology, vol. 7, no 8, , p. 560-565 (PMID 21706034, PMCID 3462652, DOI 10.1038/nchembio.594, lire en ligne [archive])
- (en) John R. Cooper et Helen S. Gowing, « The Binding of Americium and Curium to Human Serum Proteins », International Journal of Radiation Biology and Related Studies in Physics, Chemistry and Medicine, vol. 40, no 5, , p. 569-572 (PMID 6975262, DOI 10.1080/09553008114551541, lire en ligne [archive])
- (en) David M. Taylor et George J. Kontoghiorghes, « Mobilisation of plutonium and iron from transferrin and ferritin by hydroxypyridone chelators », Inorganica Chimica Acta, vol. 125, no 3, , L35-L38 (DOI 10.1016/S0020-1693(00)84710-6, lire en ligne [archive])
- (en) David M. Taylor, Arnulf Seidel, Felicitas Planas-Bohne, Ute Schuppler, Margarethe Neu-Müller et Rainer E. Wirth, « Biochemical studies of the interactions of plutonium, neptunium and protactinium with blood and liver cell proteins », Inorganica Chimica Acta, vol. 140, , p. 361-363 (DOI 10.1016/S0020-1693(00)81124-X)
- (en) F. W. Bruenger, B. J. Stover et W. Stevens, « 239Pu(IV): its subcellular distribution and association with ferritin in the canine liver », Health Physics, vol. 21, no 5, , p. 679-687 (PMID 5112182, DOI 10.1097/00004032-197111000-00009, lire en ligne [archive])
- (en) G. Boocock, C. J. Danpure, D. S. Popplewell et D. M. Taylor, « The Subcellular Distribution of Plutonium in Rat Liver », Radiation Research, vol. 42, no 2, , p. 381-396 (PMID 4315168, DOI 10.2307/3572805, JSTOR 3572805, lire en ligne [archive])
- (en) N. P. Singh, M. D. E. Wrenn et S. A. Ibrahim, « Plutonium concentration in human tissues: comparison to thorium », Health Physics, vol. 44, no Suppl. 1, , p. 469-476 (PMID 6862922, DOI 10.1097/00004032-198306001-00045, lire en ligne [archive])
- (en) « Appendix D. Overview of basic radiation physics, chemistry, and biology [archive] » [PDF], Toxic Substances Portal, sur ATSDR - Plutonium, Agency for Toxic Substances and Disease Registry (ATSDR) et U.S. Environmental Protection Agency (EPA), (consulté le ), p. D-4.
- (en) K. Konzen et R. Brey, « Development of the Plutonium-DTPA Biokinetic Model », Health Physics, vol. 108, no 6, , p. 565-573 (PMID 25905517, DOI 10.1097/HP.0000000000000283, lire en ligne [archive])
- (en) M. Alex Brown, Alena Paulenova et Artem V. Gelis, « Aqueous Complexation of Thorium(IV), Uranium(IV), Neptunium(IV), Plutonium(III/IV), and Cerium(III/IV) with DTPA », Inorganic Chemistry, vol. 51, no 14, , p. 7741-7748 (PMID 22738207, DOI 10.1021/ic300757k, lire en ligne [archive])
- (en) F.Ménétrier, L.Grappin, P.Raynaud, C.Courtay, R.Wood, S.Joussineau, V.List, G. N. Stradling, D. M. Taylor, Ph. Bérard, M. A. Morcillo et J.Rencova, « Treatment of accidental intakes of plutonium and americium: Guidance notes », Applied Radiation and Isotopes, vol. 62, no 6, , p. 829-846 (PMID 15799861, DOI 10.1016/j.apradiso.2005.01.005, lire en ligne [archive])
- (en) A. L. Sérandour, N. Tsapis, C. Gervelas, G. Grillon, M. Fréchou, J. R. Deverre, H. Bénech, E. Fattal, P. Fritsch et J. L. Poncy, « Decorporation of plutonium by pulmonary administration of Ca-DTPA dry powder: a study in rat after lung contamination with different plutonium forms », Radiation Protection Dosimetry, vol. 127, nos 1-4, , p. 472-476 (PMID 17562654, DOI 10.1093/rpd/ncm300, lire en ligne [archive])
- (en) David M. Taylor, Susan A. Hodgson et Neil Stradling, « Treatment of human contamination with plutonium and americium: would orally administered Ca- or Zn-DTPA be effective? », Radiation Protection Dosimetry, vol. 127, nos 1-4, , p. 469-471 (PMID 17556346, DOI 10.1093/rpd/ncm299, lire en ligne [archive])
- (en) Pihong Zhao, Vadim V. Romanovski, Donald W. Whisenhunt Jr, Darleane C. Hoffman, Thomas R. Mohs, Jide Xu et Kenneth N. Raymond, « Extraction of plutonium by chelating hydroxypyridinone and catecholamide resins », Solvent Extraction and Ion Exchange, vol. 17, no 5, , p. 1327-1353 (DOI 10.1080/07366299908934651, lire en ligne [archive])
- (en) V. Volf, R. Burgada, K. N. Raymond et P. W. Durbin, « Early Chelation Therapy for Injected Pu-238 and Am-241 in the Rat: Comparison of 3,4,3-LIHOPO, DFO-HOPO, DTPA-DX, DTPA and DFOA », International Journal of Radiation Biology, vol. 63, no 6, , p. 785-793 (PMID 8100266, DOI 10.1080/09553009314552191, lire en ligne [archive])
- (en) A. Blanchard, K. R. Yates, J. F. Zino, D. Biswas, D. E. Carlson, H. Hoang et D. Heemstra, « Updated Critical Mass Estimates for Plutonium-238 [archive] », sur osti.gov, U.S. Department of Energy: Office of Scientific & Technical Information (consulté le ).
- (en) John Malik, « The Yields of the Hiroshima and Nagasaki Nuclear Explosions [archive] » [PDF], sur fas.org, Laboratoire national de Los Alamos, (consulté le ).
- (en) C. E. Till, Y. I. Chang, Plentiful Energy: The Story of the Integral Fast Reactor, the Complex History of a Simple Reactor Technology, with Emphasis on Its Scientific Basis for Non-specialists, 2011, Charles E. Till and Yoon Il Chang, pp. 254-256. (ISBN 978-1-4663-8460-6)
- (en) (en) « Plutonium Storage at the Department of Energy's Savannah River Site: First Annual Report to Congress [archive] » [PDF], sur dnfsb.gov, Defense Nuclear Facilities Safety Board, (consulté le ), A-1.
- (en) Theodore M. Besmann, « Thermochemical Behavior of Gallium in Weapons-Material-Derived Mixed-Oxide Light Water Reactor (LWR) Fuel », Journal of the American Ceramic Society, vol. 81, no 12, , p. 3071–3076 (DOI 10.1111/j.1151-2916.1998.tb02740.x, lire en ligne [archive])
- (en) « Huge radioactive leak closes Thorp nuclear plant [archive] », sur theguardian.com, The Guardian, (consulté le ).
- (en) « From heat sources to heart sources: Los Alamos made material for plutonium-powered pumper [archive] », sur lanl.gov, Laboratoire national de Los Alamos (consulté le ).
- (en) « Why the Cassini Mission Cannot Use Solar Arrays », sur web.archive.org, Jet Propulsion Laboratory, (consulté le ).
- (en) « Voyager Spacecraft »(Archive.org • Wikiwix • Archive.is • https://www.jpl.nasa.gov/voyager/mission/spacecraft/" rel="nofollow" class="external text">Google • Que faire ?), sur jpl.nasa.gov, Jet Propulsion Laboratory (consulté le ).
- (en) Venkateswara Sarma Mallela, V. Ilankumaran et N.Srinivasa Rao, « Trends in Cardiac Pacemaker Batteries », Indian Pacing and Electrophysiology Journal, vol. 4, no 4, , p. 201-212 (PMID 16943934, PMCID 1502062, lire en ligne [archive])
- (en) « Plutonium Powered Pacemaker (1974) [archive] », sur orau.org, Oak Ridge Associated Universities (en), (consulté le ).
- (en) « Plutonium [archive] », sur world-nuclear.org, Association nucléaire mondiale (consulté le ).
- « Code de la défense [archive] », sur legifrance.gouv.fr (consulté le ).
- Henri Métivier, « Plutonium - Mythes et réalités [archive] » (consulté le ).
- Plutonium production [archive], Federation of American Scientists.
- (en) E.F. Hammel, « The taming of "49" — Big Science in little time. Recollections of Edward F. Hammel [archive] », Los Alamos Science, Vol 26, Iss. 1, 2000 (consulté le ). Cette convention a été étendue pour tous les actinides, dans les équations décrivant la dynamique de leur population dans des réacteurs. Ainsi, l'isotope 235 de l'uranium (92) reçoit dans les équations l'indice 25 et ainsi de suite.
- (en) D. C. Hoffman, F. O. Lawrence, J. L. Mewherter et F. M. Rourke, « Detection of Plutonium-244 in Nature », Nature, vol. 234, no 5325, , p. 132-134 (DOI 10.1038/234132a0, Bibcode 1971Natur.234..132H, lire en ligne [archive])
- Rapport Bataille [archive] 1997/1998 au Sénat.
Voir aussi
Sur les autres projets Wikimedia :
Bibliographie
- (en) David R. Lide et al., Handbook of Chemistry and Physics, Boca Raton (FL), CRC Press, Taylor & Francis Group, , 87e éd., 2608 p. (ISBN 0-8493-0487-3)
- Sandrine Matton ; Mesures in vitro et in vivo des paramètres de dissolution des oxydes mixtes d'uranium et de plutonium en milieu biologique (In vitro and in vivo measurements of dissolution parameters of mixed uranium and plutonium oxides in biological medium) ; Thèse de Sandrine Matton (sous la direction de Michel Genet), soutenue à l'université de Paris 11 Orsay (Inist CNRS [archive])
- IEER, Énergie & Sécurité no 3 [archive] Sommaire : L'utilisation du plutonium militaire comme combustible de réacteur ; Les effets du plutonium sur la santé ; Le MOX en France et en Belgique ; Situation et perspective pour la production du combustible MOX en Russie ; La transmutation n'est pas une alternative à l'enfouissement ; La transformation du plutonium avec le temps], Énergie & Sécurité no 3, 1997 (scan PDF)
Articles connexes
Liens externes